進行食道胃接合部癌および胃癌に対するPembrolizumabの安全性と有効性を評価したマルチコホート第II相試験(KEYNOTE-059試験)
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
胃癌に対する免疫チェックポイント阻害剤については、2017年消化器癌シンポジウムで発表されたONO-4538-12試験(ATTRACTION-2)において標準治療不応胃癌患者に対するNivolumabとプラセボの比較が行われ、Nivolumab単剤によるOS(overall survival)延長効果が示された。同じIgG4抗PD-1抗体薬であるPembrolizumabが単剤で胃癌に対してどの程度の効果を示すのか、アジア人と西洋人に人種間格差はあるのか、また、初回治療例に対する化学療法との併用でどのような毒性および有効性プロファイルを示すのかが、KEYNOTE-059試験では注目された。
コホート1では3rd line以降の切除不能胃癌患者259例に単独投与され、奏効率11.6%、PFS(progression-free survival)中央値2.0ヵ月、OS中央値5.6ヵ月と、ONO-4538-12試験におけるNivolumab(それぞれ11.2%、1.61ヵ月、5.32ヵ月)とほぼ同様な結果が示された。また、コホート2におけるフッ化ピリミジン系製剤+Cisplatinとの併用では、奏効率60%、PFS中央値6.6ヵ月、OS中央値20.8ヵ月と、Pembrolizumab併用により高い効果が得られることが示された。さらに、探索的に行われたマイクロサテライト不安定性症例に対する解析では、胃癌においても免疫チェックポイント阻害剤が高い奏効を示すことが示された。
KEYNOTE-059は3つのコホートを比較するデザインになっておらず、それぞれの結果には選択バイアスがかかっている。既存の治療との比較については、単剤では胃癌2nd line例を対象にしたPaclitaxelとの比較試験であるKEYNOTE-061試験1)が、胃癌1st line例ではフッ化ピリミジン系製剤+Cisplatin±Pembrolizumab併用療法とPembrolizumab単独療法を比較するKEYNOTE-062試験2)が行われており、結果が待たれるところである。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
#4003
KEYNOTE-059 cohort 1: Efficacy and safety of Pembrolizumab monotherapy in patients with previously treated advanced gastric cancer.
Charles S. Fuchs, et al.
#4012
KEYNOTE-059 cohort 2: Safety and efficacy of pembrolizumab plus 5-fluorouracil and Cisplatin for first-line treatment of advanced gastric cancer.
Yung-Jue Bang, et al.
胃癌に対してPembrolizumabで治療を行うことの論拠
進行胃癌に対する1st lineの標準治療はフッ化ピリミジン系製剤と白金製剤の併用であるが、OS中央値は8~17ヵ月であり、決して満足できる結果ではない3,4)。一方、腫瘍細胞に発現しているPD-L1はリンパ球のPD-1と結合することで腫瘍に対する免疫寛容を生み出し、胃癌にはPD-L1が過剰発現していることが報告されている5-7)。
PembrolizumabはPD-1に選択的に結合するヒト化モノクローナル抗体であり、PD-1とPD-L1との結合を阻害することで腫瘍への免疫寛容を破綻させる。Pembrolizumabは既に臨床への応用が試みられており、第Ib相試験のKEYNOTE-012試験では、切除不能の胃または食道胃接合部腺癌に対する忍容可能な毒性および有望な有効性が示唆された8)。以上より、進行食道胃接合部腺癌および胃癌に対するPembrolizumab単独療法または標準治療への併用療法を検討する第II相試験、KEYNOTE-059試験が行われ、今回、コホート1及びコホート2に関する結果が報告された。
3rd line以降の単独治療(コホート1)と初回治療の標準治療との併用療法(コホート2)
コホート1における主な適格規準は、ECOG PS 0-1、HER2陰性、HER2陽性であればHER2標的療法による前治療歴、2レジメン以上の前治療歴、ステロイドやPD-1/PD-L1標的療法の治療歴なし、脳転移や腹水を有さない、測定可能病変を有する切除不能胃癌または食道胃接合部癌患者であり、対象患者はPembrolizumab単剤(200mg)を3週毎に投与された。主要評価項目は全症例およびPD-L1陽性例における中央判定による奏効率、安全性であり、副次評価項目は中央判定によるDOR(duration of response)、PFS、OSであった。また、マイクロサテライト不安定性(MSI)と効果の関連についても探索的に検討された。
コホート2における主な適格規準は、ECOG PS 0-1、HER2陰性、未治療で測定可能病変を有する切除不能胃癌または食道胃接合部癌患者であり、対象患者はCDDP(80mg/m2, 3週毎6サイクルまで)+5-FU(800mg/m2, 5日間持続静注, 3週毎)またはCapecitabine(1,000mg/m2, 1日2回, 2週投与1週休薬, *日本のみ)にPembrolizumab(200mg, 3週毎)を併用した。主要評価項目は安全性であり、副次評価項目は全症例およびPD-L1陽性例における奏効率、病勢コントロール率、DOR、PFS、OSであった。
なお、PD-L1発現は22C3抗体を用いた免疫組織染色にて測定され、CPS(Combined Positive Score)1%以上を陽性とした(CPS=PD-L1で染色された細胞数(腫瘍細胞、リンパ球、マクロファージ)/全生存細胞数×100)。
単独療法においてPembrolizumabは安全性と有効性を示した
コホート1では259例が登録され、主な患者背景は、年齢中央値62歳(範囲24-89)、男性76.4%、地域:米国124例(47.9%)、アジア34例(13.1%)、治療ライン:3rd line 134例(51.7%)、4th line 75例(29.0%)、5th line以降50例(19.3%)、胃癌に対する手術歴あり66例(25.5%)、HER2陽性63例(24.3%)、PD-L1陽性148例(57.1%)であった。
観察期間中央値5.8ヵ月(0.5-21.6)において、主要評価項目である奏効率は、全体11.6%(95% CI: 8.0-16.1)、PD-L1陽性例15.5%(95% CI: 10.1-22.4)であった。また、ベースラインより腫瘍縮小が得られた症例は、全体42.4%、PD-L1陽性例47.3%、PD-L1陰性例36.3%であった(図1)。
図1
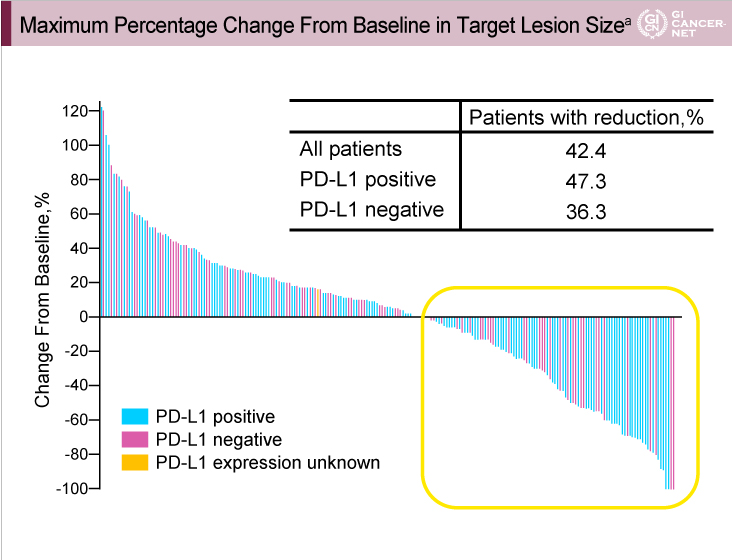
発表者の許可を得て掲載(approved by Charles S. Fuchs)
奏効が得られた症例の多くがカットオフ時点においても治療を継続しており、最大で21ヵ月間治療を継続していた(図2)。
図2
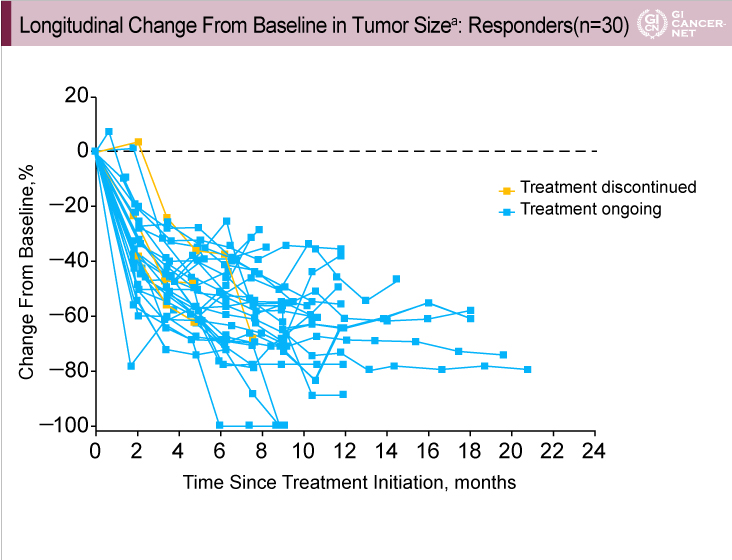
発表者の許可を得て掲載(approved by Charles S. Fuchs)
DOR中央値は全体で8.4ヵ月(95% CI: 1.6-17.3)であり、PD-L1陽性例16.3ヵ月(95% CI: 1.6-17.3)、PD-L1陰性例6.9ヵ月(95% CI: 2.4-7.0)であった(図3)。
図3
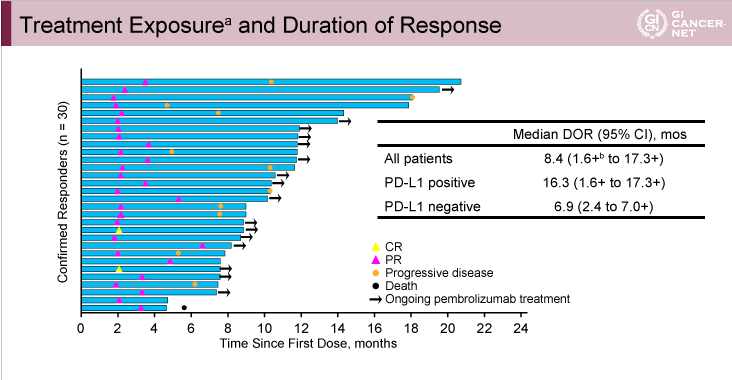
発表者の許可を得て掲載(approved by Charles S. Fuchs)
奏効率を治療ライン別に検討したところ、3rd lineにおける奏効率は16.4%(95% CI: 10.6-23.8)であったのに対し、4th line以降では6.4%(95% CI: 2.8-12.2)であった。なお、MSIを検索した174例における奏効率は、MSI-High症例(7例)57.1%(95% CI: 18.4-90.1)、non-MSI-High症例(167例)9.0%(95% CI: 5.1-14.4)であった。
PFS中央値は2.0ヵ月(95% CI: 2.0-2.1)(図4)であり、OS中央値は5.6ヵ月(95% CI: 4.3-6.9)であった。
図4
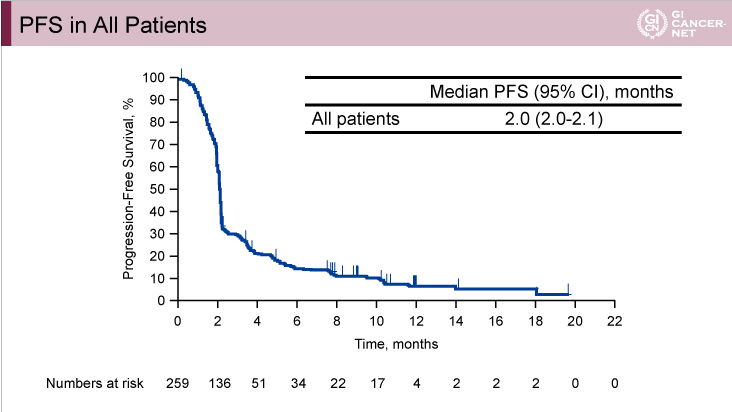
発表者の許可を得て掲載(approved by Charles S. Fuchs)
頻度が高かった治療関連有害事象は、疲労(18.9%)、そう痒症(8.9%)、皮疹(8.5%)などであり、grade 3以上の治療関連有害事象は、貧血(2.7%)、疲労(2.3%)、下痢(1.2%)などを認めた。免疫関連有害事象に関しては、全gradeで17.8%(甲状腺機能低下症8.9%、甲状腺機能亢進症3.5%、大腸炎2.3%など)、grade 3以上で4.6%(重篤な皮膚障害1.5%、大腸炎1.2%、肺臓炎0.8%など)に認められた。
標準治療との併用療法においてもPembrolizumabは安全性と有効性を示した
コホート2では25例が登録され、主な患者背景は、年齢中央値64歳(範囲21-82)、男性16例(64%)、人種:アジア人17例(68%)、白人8例(32%)、胃癌に対する手術歴あり5例(20%)、PD-L1陽性16例(64%)であった。
観察期間中央値14.7ヵ月(1.8-21.0)において、25例中21例が治療中止(16例が病勢進行による中止)となり、4例が治療継続中であった。奏効率は全体60%(95% CI: 39-79)、PD-L1陽性例69%(95% CI: 41-89)であり、治療前後で画像評価可能であった24例は全例で腫瘍縮小を経験した(図5A)。なお、標的病変は数サイクルで縮小を認め、その後も縮小を維持しており(図5B)、DOR中央値は5ヵ月(3-18)であった(図5C)。
図5
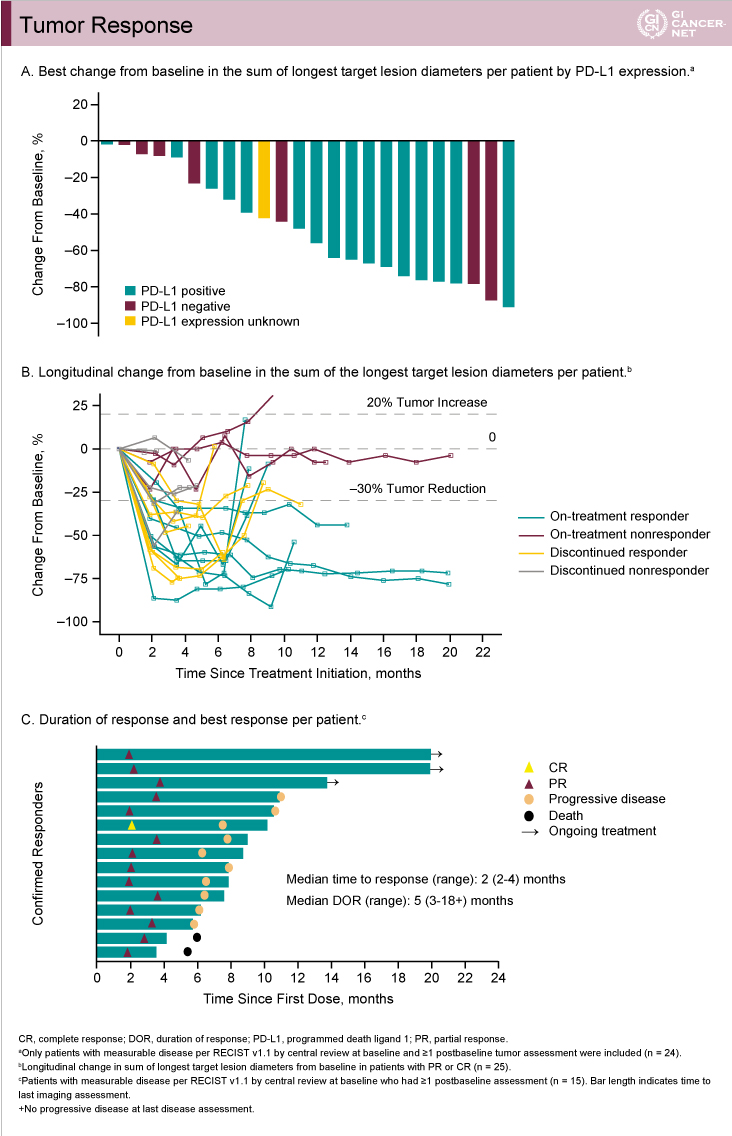
発表者の許可を得て掲載(approved by Yung-Jue Bang)
PFS中央値は6.6ヵ月(95% CI: 5.9-10.6)であり(図6上)、OS中央値は20.8ヵ月(95% CI: 7.3-not estimable)であった(図6下)。
図6
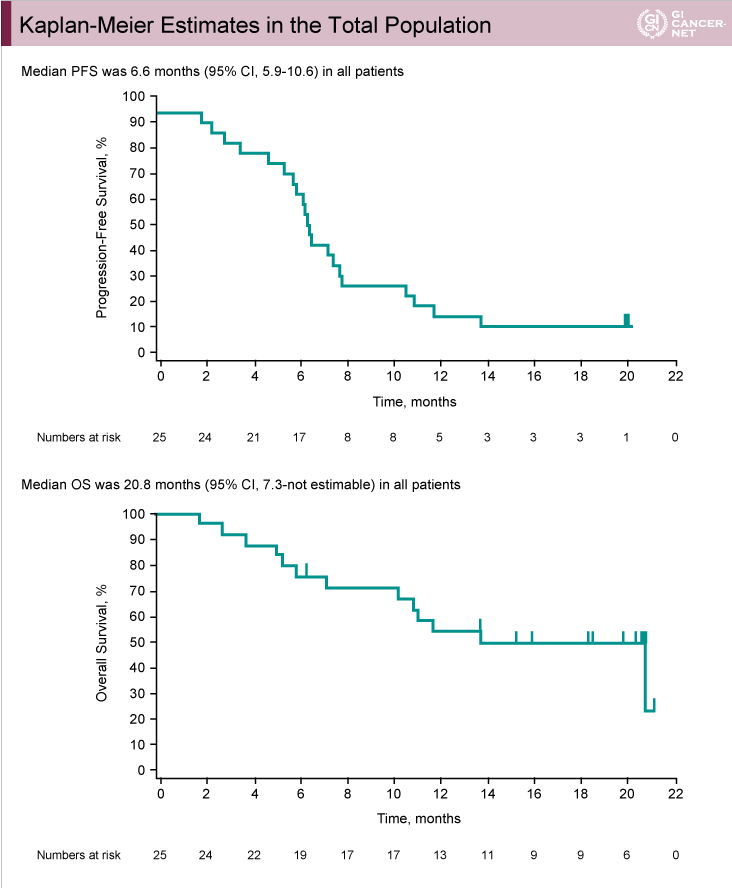
発表者の許可を得て掲載(approved by Yung-Jue Bang)
安全性に関しては、全gradeの治療関連有害事象を全例に認め、grade 3/4の治療関連有害事象は、好中球減少16例(64%)、口内炎5例(20%)、貧血、食欲不振、疲労、手足症候群、血小板減少がそれぞれ2例(8%)に認められた。なお、3例が化学療法関連有害事象により治療が中止された(grade 3 口内炎、grade 2 聴力低下、grade 1 クレアチニン上昇)。免疫関連有害事象は全gradeで12例(48%)に認められ、grade 3は3例(12%)に認められた(発疹/班状丘疹2例、腎炎1例)。ただ、治療関連死を認めず、毒性も忍容可能であった。
まとめ
Pembrolizumabは、3rd line以降の単独療法、フッ化ピリミジン系製剤(5-FUまたはCapecitabine)+CDDPとの併用療法のいずれにおいても、有望な有効性と管理可能な毒性が示された。また、いずれにおいてもPD-L1陽性例で奏効率が上昇する傾向が認められた。現在、1st lineにおけるPembrolizumab単独療法とCDDP+5-FU(またはCapecitabine)±Pembrolizumab併用療法を比較する第III相比較試験、KEYNOTE-062試験2)が進行中である。
(レポート:国立がん研究センター中央病院 消化管内科 がん専門修練医 宮本 敬大)
References
1) A Study of Pembrolizumab (MK-3475) Versus Paclitaxel for Participants With Advanced Gastric/Gastroesophageal Junction Adenocarcinoma That Progressed After Therapy With Platinum and Fluoropyrimidine (MK-3475-061/KEYNOTE-061) [CT.gov]
2) Study of Pembrolizumab (MK-3475) as First-Line Monotherapy and Combination Therapy for Treatment of Advanced Gastric or Gastroesophageal Junction Adenocarcinoma (MK-3475-062/KEYNOTE-062) [CT.gov]
3) Harada K, et al.: Gastric Cancer. 20(Suppl 1): 92-101, 2017[PubMed]
4) Lordick F, et al.: Ann Oncol. 2017[Epub ahead of print][PubMed]
5) Disis ML, et al.: J Clin Oncol. 28(29): 4531-4538, 2010[PubMed]
6) Kim JW, et al.: Gastric Cancer. 19(1): 42-52, 2016[PubMed]
7) Qing Y, et al.: Drug Des Devel Ther. 9: 901-909, 2015[PubMed]
8) Muro K, et al.: Lancet Oncol. 17(6): 717-726, 2016[PubMed][論文紹介]
関連リンク
3rd-line以降のsalvage lineにおける進行胃癌に対するNivolumab(ONO-4538-12試験)[学会レポート]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師