切除不能進行・再発胃癌に対するDocetaxel+Cisplatin+S-1(DCS)療法とCisplatin+S-1(CS)療法を比較した無作為化第III相試験(JCOG1013試験)
Phase III study comparing triplet chemotherapy with S-1 and cisplatin plus docetaxel versus doublet chemotherapy with S-1 and cisplatin for advanced gastric cancer (JCOG1013)
Yasuhide Yamada, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
日本の国民的癌ともいえる胃癌の一次化学療法の標準治療は10年前に報告されたCisplatin+S-1(CS)療法1)であり、これまでさまざまな分子標的治療薬の併用による第III相試験が行われてきたが、いずれもネガティブな結果であった。JCOG1013は化学療法を3剤併用することで予後の改善が可能かどうかを検証した試験である。3剤併用については、Cisplatin+5-FU(CF)療法とDocetaxel+Cisplatin+5-FU療法(DCF療法)を比較したV325試験2)では、全生存(OS)期間を延長したものの毒性の高さが問題となり一般化されていなかったが、Docetaxel+Cisplatin+S-1(DCS)療法では、Docetaxelの投与量を抑えることで有効性を保ったまま毒性を軽減することが第II相試験3)で示されたため、今回の検討がなされた。3剤対2剤の比較試験では、2剤群の後治療として、高い確率でもう一剤の投与が行われるため、無増悪生存(PFS)や、奏効率(ORR)では3剤群が勝っても、OSで差がでるかどうかがポイントとなる。
本試験デザインでもCS療法後、高確率でPaclitaxelベースの治療をすることが想定されていた。そのため、DCS療法における完全奏効(CR)例がどの程度出るか、また、大腸癌におけるFOLFOXIRI療法のように、腫瘍縮小によりConversion Surgeryが可能となる症例がどの程度出るのかがポイントと考えられていた。
結果としては、CS療法よりもDCS療法のほうがORRは高かったが有意差を示すほどでもなく、CRも2例と期待されたほどではなかった。PFS期間、および、主要評価項目であるOS期間においてもCS療法とDCS療法に差はなく、3剤併用による生存期間の延長を狙ったDCS療法の効果は証明されなかった。また、比較的予後が悪くDocetaxelの有効性が期待されたびまん型胃癌におけるOS期間は、主要な副次評価項目とされていたが、ここでも予後の延長は証明できなかった。
その要因の1つとして、Docetaxelの投与量が考えられる。DCS療法(40mg/m2、4週間毎)の投与量は、ポジティブとなったV325試験(75mg/m2、3週間毎)の40%である。ただ、高い治療強度が必ずしも長期の有効性に反映されないのは、V325試験や、JCOG9912試験4)におけるCPT-11+Cisplatin療法の結果にも示されており、より高いDocetaxelの用量を選択したからといって、OSに反映されたかどうかは不明である。ポスターディスカッションにおいても、二次化学療法ではCS療法群でタキサン系薬剤が多く入っており、これによりびまん型でも十分な効果が得られたと考えられることが指摘され、治療戦略は二次治療まで含めたものが必要であるという結論であった。本試験の結果、初回治療の標準治療はフッ化ピリミジンとプラチナ製剤の併用療法のままであり、新しい標準治療が誕生するかどうかは、今後の免疫チェックポイント阻害剤との併用試験の結果を待つ必要がある。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
日本における切除不能進行・再発胃癌に対するDocetaxel+Cisplatin+S-1(DCS)療法
日本における切除不能進行・再発胃癌に対する一次化学療法の標準治療は、Cisplatin+S-1(CS)療法である1)。しかし、切除不能進行・再発胃癌の治療成績は十分とはいえず、さらなる治療開発への期待から国内における3剤併用療法の開発として、CS療法にDocetaxelを加えたDCS療法の早期臨床試験が複数行われてきた。これらの試験では高い奏効率が認められた一方で、Grade 3以上の好中球数減少や発熱性好中球減少症などの有害事象が高頻度でみられた。北里大学から報告されたDCS療法[(Docetaxel 40mg/m2、day 1)+(Cisplatin 60-70mg/m2、day 1)+(S-1 80mg/day、day 1-14)、4週毎]では第II相試験における高い奏効率(82.5%)と優れた忍容性が認められ3)、この結果を基に、DCS療法とCS療法を比較する無作為化第III相試験(JCOG1013試験)が計画された。
CS療法に対するDCS療法の優越性を検証
JCOG1013試験の対象は切除不能進行・再発胃癌患者であり、標準治療であるCS療法に対するDCS療法の優越性が検証された。主たる適格規準は、切除不能進行もしくは再発、組織学的に腺癌、20歳以上75歳以下、HER2陰性もしくは未評価、測定可能病変の有無は問わない、経口摂取が可能、過去に化学療法や放射線療法を受けていない(術後化学療法の終了後6ヵ月以上の再発は除く)、臓器機能が保たれていることなどであった。
対象患者は、CS療法群[(Cisplatin 60mg/m2、day 8)+(S-1 80-120mg/day、day 1-21)、5週毎]とDCS療法群[(Docetaxel 40mg/m2、day 1)+(Cisplatin 60mg/m2、day 1)+(S-1 80-120mg/day、day 1-14)、4週毎]に1:1で無作為に割り付けられた。層別因子は、施設、PS(performance status)0 vs. 1、測定可能病変の有無、病期(切除不能 vs. 再発)、転移個数(0-1 vs. ≧2)、組織型(腸型 vs. びまん型)であった。
主要評価項目はOS期間で、副次評価項目はPFS期間、奏効率、治療強度、有害事象であった。また、主要な副次評価項目(key secondary endpoint)として、組織型別(腸型 vs. びまん型)のOS期間が事前に設定されていた。
OS期間中央値(MST)をCS療法群13.5ヵ月、DCS療法群16.5ヵ月とし、ハザード比(HR)=0.845、片側検定α=0.05、検出力80%、必要な登録数は740例と設定された。
2012年4月から2016年3月までに741例が登録、CS療法群(371例)とDCS療法群(370例)に割り付けられ、2017年9月までのデータが解析された。プロトコール治療の中止理由は、病勢進行(72.8% vs. 68.6%)、有害事象(10.5% vs. 10.8%)で、両群に差は認められなかった。
患者背景は、年齢中央値が両群とも65歳、男性/女性は両群とも約69%/31%、PS 0/1は両群とも約65%/35%、組織型は腸型/びまん型が両群とも約35%/65%であった。転移臓器数が2個以上の症例割合は両群とも約58%であり、リンパ節(両群とも約70%)、腹膜播種(両群とも約50%)、肝臓(両群とも約30%)の順に多く、両群で大きな差は認められなかった。
OS期間において、CS療法に対するDCS療法の優越性は示されなかった
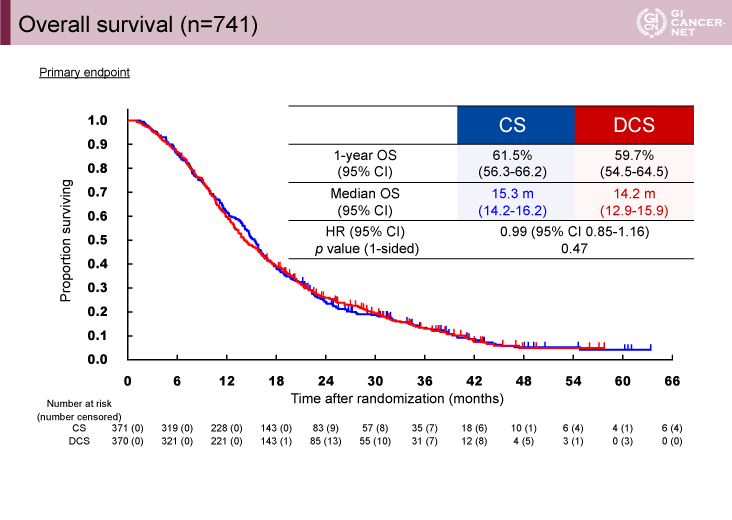
主要評価項目であるOSのMSTは、CS療法群15.3ヵ月(95% CI: 14.2-16.2)、DCS療法群14.2ヵ月(95% CI: 12.9-15.9)であり、HR=0.99(95% CI: 0.85-1.16、p=0.47)で統計学的に有意差は認められなかった(図1)。
図1 Overall survival(発表者の許可を得て掲載)
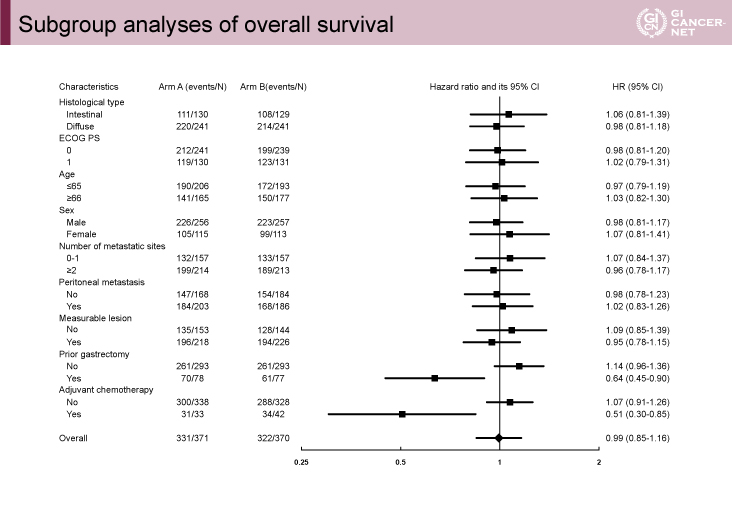
副次評価項目である組織型別のOSは、腸型(HR=1.06、95% CI: 0.81-1.39)、びまん型(HR=0.98、95% CI: 0.81-1.18)で、両群に有意差は認められなかった。びまん型が、腸型に比べ有意に予後が不良であった(MST: 13.7 vs. 17.5ヵ月)。その他のサブグループ解析は、図2のとおりであった。
図2 Subgroup analyses of overall survival(発表者の許可を得て掲載)
PFS期間、奏効率においても、CS療法とDCS療法に有意差は認められなかった
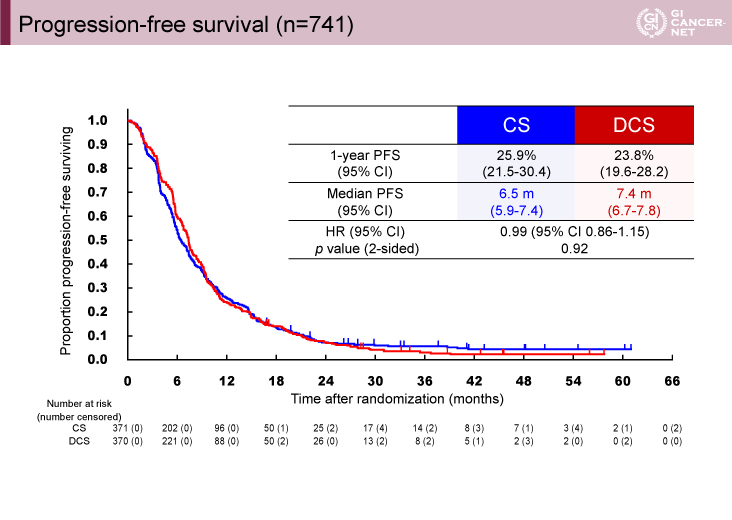
PFS中央値は、CS療法群6.5ヵ月(95% CI: 5.9-7.4)、DCS療法群7.4ヵ月(95% CI: 6.7-7.8)、HR=0.99(95% CI: 0.86-1.15、両側p=0.92)であり、両群に有意差は認められなかった(図3)。測定可能病変を有する444例における奏効率は、CS療法群56.0%[CR 0%、PR 56.0%]、DCS療法群59.3%(CR 0.9%、PR 58.4%)で、両群で統計学的な差は認められなかった(p=0.50)。
図3 Progression-free survival(発表者の許可を得て掲載)
忍容性が確認されたDCS療法と二次化学療法の選択
CS療法群とDCS療法群におけるGrade 3以上の有害事象は、リンパ球数減少(16.4% vs. 33.6%)、好中球数減少(32.1% vs. 58.5%)、ヘモグロビン減少(24.4% vs. 23.2%)、血小板数減少(8.5% vs. 3.9%)、発熱性好中球減少症(5.7% vs. 7.6%)、低ナトリウム血症(12.3% vs. 14.3%)、疲労(11.4% vs. 11.2%)、食欲不振(22.1% vs. 26.3%)、下痢(7.4% vs. 7.0%)、悪心(7.4% vs. 8.7%)、嘔吐(2.5% vs. 2.2%)、口内炎(2.2% vs. 2.5%)、治療関連死亡(1例vs. 3例、どちらも<1%)であった。好中球数減少ならびにリンパ球数減少はCS療法群に比べDCS療法群で発現頻度が高かったが、発熱性好中球減少症の発現頻度は両群で大きな差は認められなかった。非血液毒性に関しても、両群で大きな差は認められなかった。
また、プロトコール治療終了後、CS療法群で79%、DCS療法群で72%の患者が二次化学療法を受けていた。タキサン系薬剤(61% vs. 29%)、Irinotecan(13% vs. 31%)、フッ化ピリミジン系薬剤(7% vs. 16%)、プラチナ系薬剤(3% vs. 11%)、Ramucirumab(16% vs. 6%)であった。CS療法群ではタキサン系薬剤が、DCS療法群ではIrinotecanが多く選択される傾向がみられた。
まとめ
CS療法に対するDCS療法の優越性は証明されなかった。日本における切除不能進行・再発胃癌に対する一次化学療法の標準治療はCS療法である。
(レポート:埼玉県立がんセンター 消化器内科 高橋 直樹)
References
1) Koizumi W, et al.: Lancet Oncol. 9(3): 215-221, 2008[PubMed][論文紹介]
2) Van Cutsem E, et al.: J Clin Oncol. 24(31): 4991-4997, 2006[PubMed][論文紹介]
3) Koizumi W, et al.: Cancer Chemother Pharmacol. 69(2): 407-413, 2012[PubMed]
4) Boku N, et al.: Lancet Oncol. 10(11): 1063-1069, 2009[PubMed]
関連リンク
Phase III study of cisplatin plus S-1 (CS) compared with docetaxel and cisplatin plus S-1 (DCS) as first-line therapy for advanced gastric cancer(JCOG1013)[UMIN-CRT]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科