フッ化ピリミジン系薬剤、プラチナ系薬剤、Trastuzumabに不応となったHER2陽性進行再発胃癌・食道胃接合部癌に対するweekly Paclitaxel療法 vs. weekly Paclitaxel+Trastuzumab療法の無作為化第II相試験:WJOG7112G(T-ACT試験)
A randomized phase II study of weekly paclitaxel ± trastuzumab in patients with HER2-positive advanced gastric or gastro-esophageal junction cancer refractory to trastuzumab combined with fluoropyrimidine and platinum: WJOG7112G (T-ACT)
Akitaka Makiyama, et al.
監修コメント

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
本試験では、乳癌と異なり、抗HER2療法に不応となったHER2陽性胃癌に対する二次化学療法において抗HER2抗体を継続する意義は示せなかった。切除不能進行・再発胃癌の二次化学療法はPaclitaxel(PTX)が標準であり、RAINBOW試験1)の結果より、可能ならRamucirumabとの併用療法が推奨される。
本試験では二次化学療法開始直前の腫瘍組織検査でHER2陽性割合が31%と低かった。また、同日に発表されたバイオマーカーの検討において、PTX+Trastuzumab(Tmab)療法群でHER3リガンドであるNGS1が高値であった患者では、有意に全生存(OS)期間が不良であったことが示された2)。既報でもRAS、PI3KCA変異やMET増幅など二次的な遺伝子異常が発生することが報告されている3,4)。これらのことからTmab不応となった患者では、さまざまなTmab耐性機序が発生している可能性があり、二次化学療法における抗HER2療法の開発はバイオマーカーで選択された患者に対して行う必要があるのかもしれない。これまでにもHER2陽性の切除不能進行・再発胃癌の二次化学療法としてTrastuzumab Emtansine(T-DM1)5)やLapatinib6)などの抗HER2薬が検討されたが、いずれも有効性は示されておらず、二次化学療法における抗HER2療法の開発は難しいのが現状である。
現在、抗HER2療法としてTmabとDeruxtecanをリンカーで結合させた抗体薬物複合体(ADC)であるDS-8201aが開発中である。今回のASCOでも国内第I相試験のアップデートがoral presentationで発表され、Trastuzumabに不応となった胃癌、食道胃接合部癌の患者44例の奏効率(ORR)が43.2%と、非常に良好な結果が報告された7)。今後の治療開発が大いに期待される。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
HER2陽性の切除不能進行・再発胃癌における抗HER2療法
HER2陽性の切除不能進行・再発胃癌に対する一次化学療法は、ToGA試験8)の結果からCapecitabine+CisplatinにTrastuzumab(Tmab)を併用することが標準治療とされている。一方で、HER2陽性の切除不能進行・再発乳癌において、一次化学療法でTmabが不応となった後の治療として抗HER2療法継続の有用性が示されている9)。
今回、一次化学療法のTmabに不応であったHER2陽性切除不能進行・再発胃癌に対する二次化学療法として、Paclitaxel単剤(PTX療法群)とPaclitaxel+Tmab療法(PTX+Tmab療法群)を比較した無作為化第II相試験の結果が報告された。
Tmab不応後の二次化学療法におけるTmab継続投与の意義を検証
対象は、腫瘍組織でHER2陽性(IHC3または2+かつFISH>2.0)、一次化学療法としてフッ化ピリミジン系薬剤、プラチナ系薬剤、Tmab(3回以上の投与歴を有する)に不応、ECOG PS(performance status)0-2、PTXや他の抗HER2薬の投与歴がなく、Tmab最終投与から6週以内の切除不能進行・再発胃癌患者で、PTX療法群(PTX 80mg/m2、day 1,8,15、4週毎)とPTX+Tmab療法群[(PTX 80mg/m2、day 1,8,15、4週毎)+(Tmab 8mg/kg負荷用量+6mg/kg、day 1、3週毎)]に1:1で割り付けられた。層別因子は、施設、PS 0-1/2、IHC3または2+かつFISH>2.0、標的病変の有無であった。
主要評価項目は無増悪生存(PFS)期間であり、副次評価項目は、全生存(OS)期間、治療成功期間(TTF)、奏効率(ORR)、病勢制御率(DCR)、有害事象、バイオマーカーの検討であった。統計学的設定として、PFS中央値をPTX療法群3ヵ月、PTX+Tmab療法群5ヵ月とし、片側α=10%、検出力80%で、必要症例数は90例(69例のイベント数が必要)であった。
Tmabを継続投与する意義は認められず
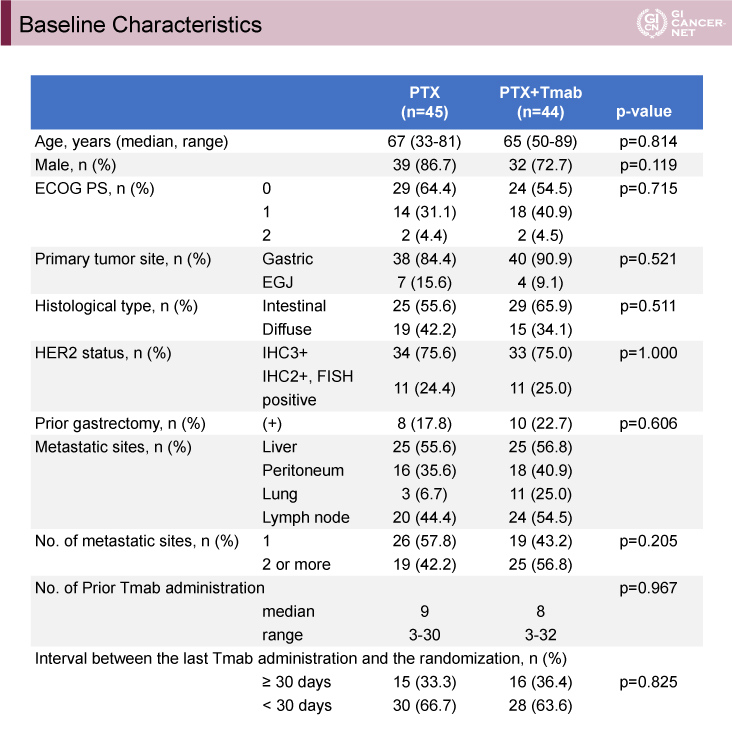
両群で91例が登録され、各群1例の不適格症例を除き、89例(PTX療法群45例、PTX+Tmab療法群44例)が解析対象となった。患者背景は両群でほぼ同等であった(表1)。
表1 患者背景(発表者の許可を得て掲載)
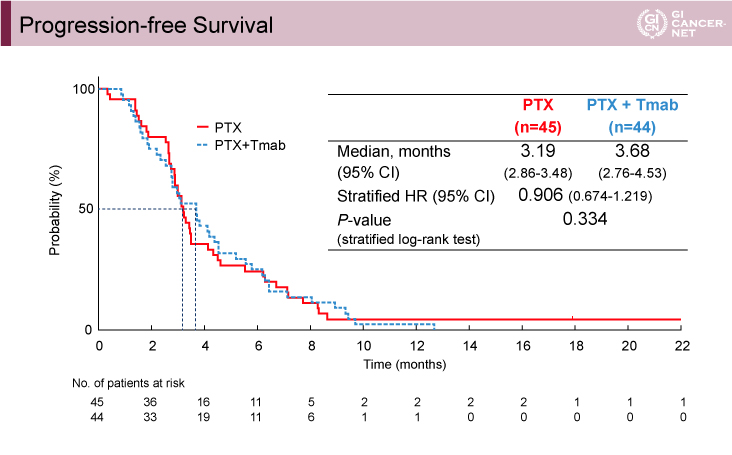
主要評価項目であるPFS中央値はPTX療法群3.19ヵ月、PTX+Tmab療法群3.68ヵ月[ハザード比(HR)=0.906、95% CI: 0.674-1.219、p=0.334)であり、PTX+Tmab療法群の優越性は示されなかった(図1)。
図1 PFS(発表者の許可を得て掲載)
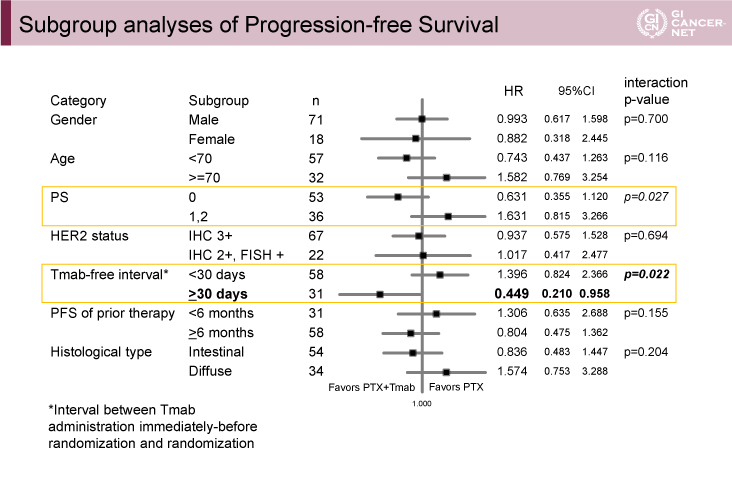
PTX療法群とPTX+Tmab療法群において、OS中央値は9.95ヵ月/10.20ヵ月(HR=1.230、95% CI: 0.759-1.991、p=0.199)、ORRは31.6%/33.3%、DCRは71.1%/61.5%であった。PFSのサブグループ解析において、PS 0、Tmab free interval(最終Tmab投与日から無作為化されるまでの期間)が30日以上の患者で、PTX+Tmab療法群が良好な傾向であった(図2)。
図2 サブグループ解析(発表者の許可を得て掲載)
バイオマーカーとして試験直前のHER2 statusが検討され、16例と少数であったもののHER2陽性は5例(31%)であった。
PTX療法群とPTX+Tmab療法におけるGrade 3/4の有害事象では、白血球数減少(18% vs. 29%)、好中球数減少(27% vs. 33%)、貧血(24% vs. 31%)がPTX+Tmab療法群で高い傾向にあり、嘔吐(4% vs. 0%)がPTX療法群で高い傾向にあったが、その他はほぼ同等であった。
まとめ
一次化学療法のTmabに不応となった切除不能進行・再発胃癌に対して、PTXにTmabを上乗せする効果は示されなかった。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 伊澤 直樹)
References
1) Wilke H, et al.: Lancet Oncol. 15(11): 1224-1235, 2014[PubMed]
2) Sukawa Y, et al.: ASCO 2018 #4029
3) Kim ST, et al.: Ann Oncol. 29(4): 1037-1048, 2018[PubMed]
4) Janjigian YY, et al.: Cancer Discov. 8(1): 49-58, 2018[PubMed]
5) Thuss-Patience PC, et al.: Lancet Oncol. 18(5): 640-653, 2017[PubMed][論文紹介]
6) Satoh T, et al.: J Clin Oncol. 32(19):2039-2049, 2014[PubMed]
7) Iwata H, et al.: ASCO 2018 #2501
8) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010[PubMed]
9) von Minckwitz G, et al.: J Clin Oncol. 27(12): 1999-2006, 2009[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科