既治療の進行胃腺癌患者に対するRamucirumab+Nivolumab療法の第I/II相試験(NivoRam試験)の早期結果
Preliminary result of phase 1/2 study of ramucirumab plus nivolumab in patients with previously treated advanced gastric adenocarcinoma (NivoRam study)
Daisuke Takahari, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
胃癌に対してPD-1抗体であるNivolumabが承認されたのは2017年の9月であり、すでに日常診療では主に三次化学療法以降に用いられている。ATTRACTION-2試験1)の結果では、Nivolumab単剤における奏効率(ORR)11%、病勢制御率(DCR)40%であったが、より効果を高めるための工夫が求められている。Ramucirumabは、RAINBOW試験2)の結果、Paclitaxelとの併用にて「胃癌の二次化学治療における標準治療となり得る」として胃癌治療ガイドライン(日本胃癌学会)に記載されている。RamucirumabがVEGFR-2を特異的に阻害し、制御性T細胞や、骨髄由来免疫抑制細胞の働きを抑えることで免疫チェックポイント阻害剤(ICI)の効果を高めることが前臨床試験の結果として報告されている。すでに、肺癌や腎癌、肝細胞癌において、血管新生阻害剤との併用でICIの効果が高まることが報告されている3-5)。
本試験は医師主導治験として行われ、胃癌においても同様の相乗効果が得られるか、毒性は許容されるものかが検討された。今回は、短期的有効性であるORRと有害事象の結果のみ報告され、主要評価項目である6ヵ月無増悪生存(PFS)期間は次回の報告となるが、ORR 24.4%、DCR 62.2%と、ATTRACTION-2試験よりも高い効果が示された。NivoRam試験は二次化学療法であり、治療Lineが若干異なるとはいえICIの効果は治療Lineによりあまり変化がないことを考えると、相乗効果があると考えるのが妥当である。今後は、この効果がどの程度持続するのか、長期使用に伴う有害事象がどのようになるのか、追加報告の結果が期待される。
これらの結果がどのように胃癌治療に組み込まれるかは、現在行われている一次化学療法にICIを併用する試験(KEYNOTE-062試験、ATTRACTION-4試験、CheckMate-649試験)や、Paclitaxel+Nivolumab+Ramucirumabの第I/II相試験の結果にかかっている。また、Late LineでのRegorafenib、Lapatinibといった経口マルチキナーゼ阻害剤の第III相試験の結果によっては、そちらとの併用を検討することもあり得る。すでに二次化学療法においてPaclitaxel+Ramucirumabが標準治療となっている胃癌において、どのLineでICIと血管新生阻害剤との併用を行えば全生存(OS)期間を延長することができるのか、今後の動きに注目である。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
進行胃癌の二次化学療法として、Nivolumab+Ramucirumab療法を評価
抗PD-1抗体である Nivolumab(Nivo)は、ATTRACTION-2試験1)において、進行胃癌患者のSalvage Lineにおいて有意な全生存(OS)期間の延長効果を示し、昨年より実臨床で広く用いられている。一方、抗VEGFR-2抗体であるRamucirumab(Ram)も進行胃癌の二次化学療法として、Paclitaxelとの併用の有用性がRAINBOW試験2)で証明され、また単剤としての有用性もREGARD試験において示されている。基礎研究においては、VEGFR-2阻害はPD-1を含む腫瘍免疫抑制分子の発現を低下させることで疲弊T細胞を回復させ、腫瘍浸潤T細胞を活性化し、腫瘍関連マクロファージを誘導させると考えられている。また、PD-1とVEGFR-2の同時遮断によってT細胞動員増強による局所免疫の相乗的抗腫瘍効果も示されている。このような背景から、今回、進行胃癌患者に対する二次化学療法としてのNivo+Ram療法の安全性および有効性を検証する第I/II相試験が計画された。
対象は、20歳以上で測定可能病変を有し、プラチナ系薬剤とフッ化ピリミジン系薬剤を含む一次化学療法に対し不応あるいは不耐、ECOG PS(performance status)0/1の進行胃癌患者とされ、Ram(8mg/kg、2週毎)+Nivo(1または3mg/kg、2週毎)が病状進行もしくは毒性中止まで投与された。
第I相パートにおいて6例で用量制限毒性(DLT)評価後、さらに40例が第II相パートに登録された。主要評価項目は6ヵ月無増悪生存(PFS)期間、副次評価項目として、奏効率(ORR)、病勢制御率(DCR)、全生存(OS)、安全性が評価された。
PD-L1発現率はPD-L1 IHC 28-8 pharmDx assayを用い免疫組織化学的に測定し、腫瘍細胞における1%以上の発現をPD-L1陽性の定義とした。
新たな有害事象はみられず、良好なORRとDCRが示された
2017年1月17日から2017年12月31日までに46例の進行胃癌患者が登録された。患者背景は、年齢中央値66歳、男性/女性は65.2%/34.8%、PS 0が59.6%、組織型は腸型50.0%/びまん型50.0%、病期IV期65.2%、再発34.8%、HER2陽性19.6%、PD-L1陽性37.0%、ミスマッチ修復機構欠損(dMMR)2.2%であった。
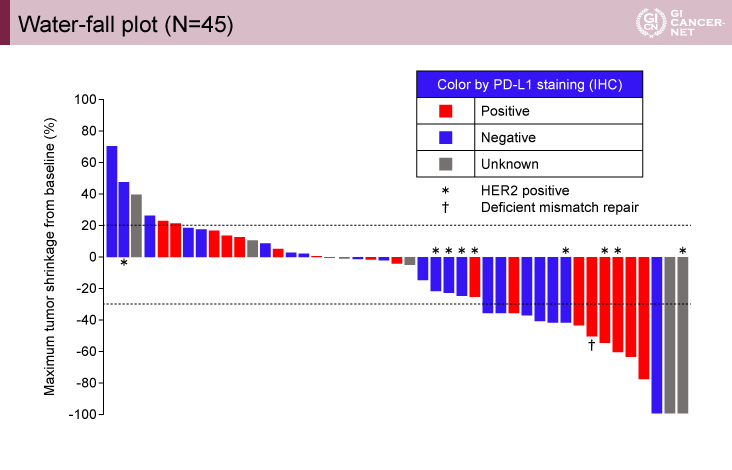
第I相パートではDLTは認められず、治療期間中央値は3.75ヵ月(データカットオフ日:2018年4月15日)であった。第II相パートの主要評価項目である6ヵ月PFS期間は未だ結果は出ておらず、ORRは部分奏効(PR)11例の24.4%(95% CI: 12.9-39.5)であり、DCRは62.2%(95% CI: 46.5-76.2)であった(表1)。また、dMMR症例、HER2発現症例に多くの腫瘍縮小が認められた(図1)。
表1 Tumor response data(発表者の許可を得て掲載)
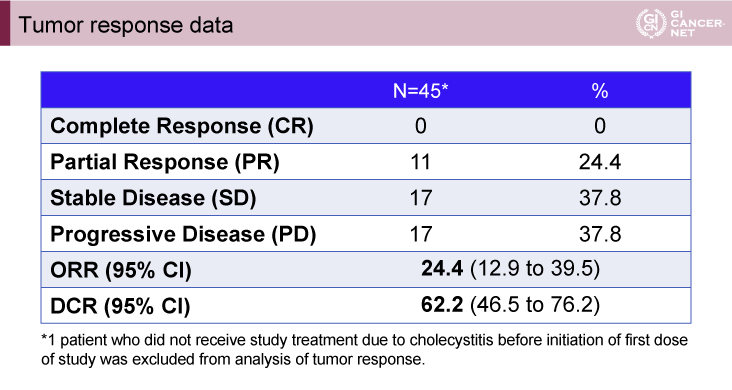
図1 Waterfall plot(N=45)(発表者の許可を得て掲載)
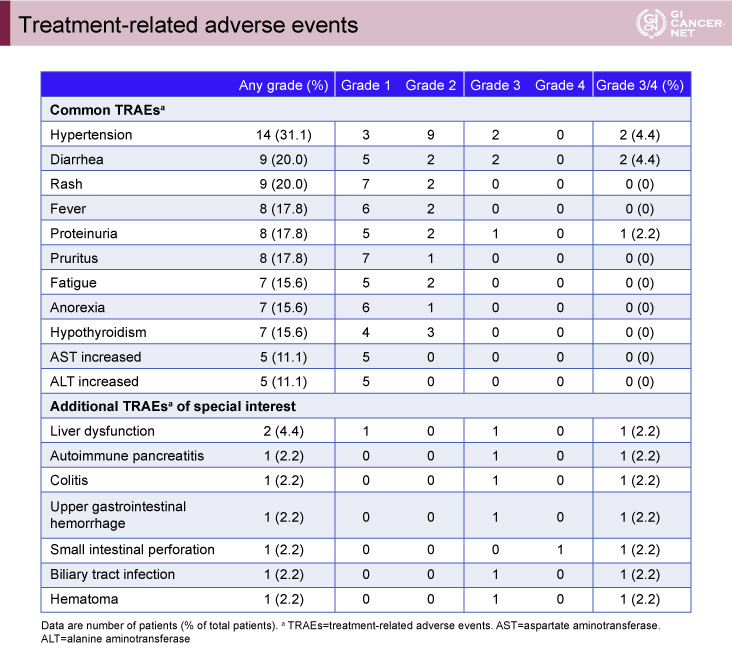
治療関連有害事象は40例(86.9%)に認められた(表2)。全Gradeでは高血圧が最も多く31.1%、下痢、発疹が各20.0%、発熱、蛋白尿、そう痒感が各17.8%であった。Grade 3/4の有害事象は、高血圧、下痢が各4.4%、蛋白尿、肝臓機能障害、自己免疫性膵炎、大腸炎、上部消化管出血、胆管炎、血腫が各2.2%で、1例にGrade 4の小腸穿孔が認められたが、治療関連死は認められなかった。
表2 Treatment-related adverse events(発表者の許可を得て掲載)
まとめ
Nivolumab+Ramucirumab療法は、既治療胃癌患者において新たな有害事象をきたすことなく安全に施行でき、かつ抗腫瘍効果としても有望な結果を示した。主要評価項目である6ヵ月PFS期間は近い将来に結果が公表される予定である。
(レポート:埼玉医科大学国際医療センター 消化器腫瘍科 堀田 洋介)
References
1) Kang YK, et al.: Lancet. 390(10111): 2461-2471, 2017[PubMed]
2) Wilke H, et al.: Lancet Oncol. 15(11): 1224-1235, 2014[PubMed]
3) Socinski MA, et al.: N Engl J Med. 2018 Jun 4 (in press) doi: 10.1056/NEJMoa1716948. [Epub ahead of print][PubMed]
4) McDermott DF, et al.: Nat Med. 24(6): 749-757, 2018 [PubMed]
5) Ikeda M, et al.: ASCO 2018 #4076
関連リンク
・A Phase 1/2 Study of Ramucirumab Plus Nivolumab in Participants With Gastric or GEJ Cancer[CT.gov][UMIN]
・RAINBOW試験とREGARD試験の概要ならびに進行胃癌治療におけるラムシルマブに関する日本胃癌学会ガイドライン委員会のコメント[PDF]
・REGARD試験[学会レポート][論文紹介]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科