腹膜播種を伴う切除不能進行・再発大腸癌に対する腹腔内温熱化学療法(HIPEC)の有用性を検討した第III相試験[PRODIGE 7(ACCORD 15)試験]
A UNICANCER phase III trial of Hyperthermic Intra-peritoneal Chemotherapy (HIPEC) for Colorectal Peritoneal Carcinomatosis: Prodige 7-ACCORD 15 trial
François Quénet, et al.
監修コメント

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
欧米の腹膜疾患治療センターでは、遠隔転移を伴わない腹膜転移症例に対して積極的な減量手術[Cytoreductive Surgery(CRS)]+腹腔内温熱化学療法(HIPEC)の併用療法が行われてきた。長期予後が得られる症例があるものの、高い周術期死亡率が問題点として挙げられる。
本試験は、従来慣習的に行われてきたHIPECの有用性を改めて検証するために実施された。腹膜播種係数[peritoneal cancer index(PCI)]<25という腹膜播種の程度が中程度以下で、ほとんどがR0/R1切除例というHIPECの効果が最も期待できるであろう患者群に対しても、CRSへのHIPECの上乗せ効果は認められなかった。近年、化学療法の進歩により、全身化学療法の効果は大きく向上している。それに伴い、腹膜への限局的な化学療法の有用性は乏しくなってきているとも解釈できる。本試験ではHIPEC群での有害事象の増加が確認されており、腹膜播種を伴う切除不能進行・再発大腸癌に対するHIPECの実施は慎むべきである。
一方で、HIPEC群とnon-HIPEC群の無再発生存(RFS)曲線をみると5年RFS割合が13~15%であり、一部の症例で治癒が得られていることが確認された。本邦の大腸癌治療ガイドラインにも「同時性限局性播種(P1、P2)は原発巣とともに切除することが望ましい。」と記載されており1)、腹膜播種を伴う切除不能進行・再発大腸癌に対する手術の意義は、むしろ本試験により確認されたといえる。登録に6年の歳月を費やした試験でネガティブに終わったが、得られたものは多い。無作為化比較試験の重要性を再認識できた素晴らしい試験であり、実施した研究者に敬意を表したい。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
腹膜播種を伴う切除不能進行・再発大腸癌に対する腹腔内温熱化学療法(HIPEC)の意義を検証
腹膜播種を伴う大腸癌患者は、他の臓器転移がある大腸癌患者と比較して予後不良である2)。そのため、腹膜播種を伴う大腸癌に対して、減量手術[Cytoreductive Surgery(CRS)]とHIPECを組み合わせた治療法が検討されてきた。Verwaalらは、腹膜播種を伴う治癒切除可能な大腸癌に対するCRS群とCRS+HIPEC群の有効性を比較し、全生存(OS)期間の中央値(MST)は、CRS+HIPEC群22.3ヵ月、CRS群12.6ヵ月、ハザード比(HR)=0.55、(95% CI: 0.32-0.95、p=0.032)と、CRS+HIPEC群でOS期間の延長を認めたことを報告した3)。しかし、全体で105例と少数例での検討であったことやCRS+HIPEC群の死亡率が8%であったことなどから、標準治療とはなっていない。
今回、腹膜播種を伴う切除不能進行・再発大腸癌に対して、HIPECの有用性を検証した第III相試験の結果が報告された。
本試験では、18歳から70歳までで、腹膜以外の他臓器への遠隔転移がなく、腹膜播種係数[peritoneal cancer index(PCI)]<25、肉眼的に完全切除可能(R0/R1)もしくは癌遺残1mm以下(R2)の手術歴がある、切除不能進行・再発大腸癌患者が対象となった。すべての患者は6ヵ月間の全身化学療法が必須であり、HIPEC施行歴のある患者は除外された。
対象患者は、HIPEC群[CRS+HIPEC(Oxaliplatin 460mg/m2、30分間腹腔内持続灌流+Leucovorin 20mg/m2+5-FU 400mg/m2、いずれも静脈内投与)4)+全身化学療法]と、non-HIPEC群(CRS+全身化学療法)に1:1で無作為に割り付けられた。全身化学療法は、術前もしくは術後に6ヵ月間施行された。層別因子は、施設、癌遺残の状態(R0/R1 vs. R2≦1mm)、以前の全身化学療法のレジメン、術前補助化学療法(neoadjuvant chemotherapy)の有無であった。
主要評価項目はOS期間、副次評価項目は、無再発生存(RFS)期間、周術期合併症を含んだ有害事象の発現率、生存の予後因子などであった。統計学的解析では、OS期間MSTをHIPEC群48ヵ月、non-HIPEC群30ヵ月と期待し、両側検定α=5%、検出力80%と設定した場合、必要解析対象数は264例(最終解析は154例のイベント数が必要)とされた。
腹膜播種を伴う切除不能進行・再発大腸癌に対して、HIPECを施行する意義は認められなかった
術前に登録された396例のうち、手術中のPCI≧25(58例)、肉眼的に腹膜播種を認めない(25例)など不適格131例を除いた265例[HIPEC群(133例)、non-HIPEC群(132例):ITT集団]が解析対象となった。患者背景では、HIPEC群にPCI 16-24の患者が、non-HIPEC群にPCI 11-15の患者がやや多い傾向であったが、その他の背景因子は両群で同程度であった。
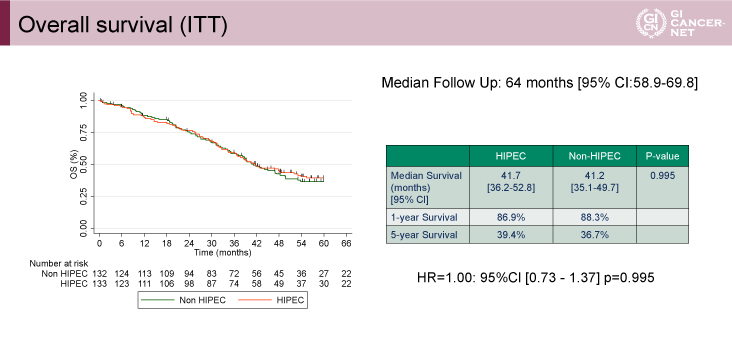
主要評価項目であるOS期間のMSTはHIPEC群41.7ヵ月、non-HIPEC群41.2ヵ月、HR=1.00(95% CI: 0.73-1.37、p=0.995)であり、HIPEC群の優越性は示されなかった(図1)。
図1 Overall survival(ITT)(発表者の許可を得て掲載)
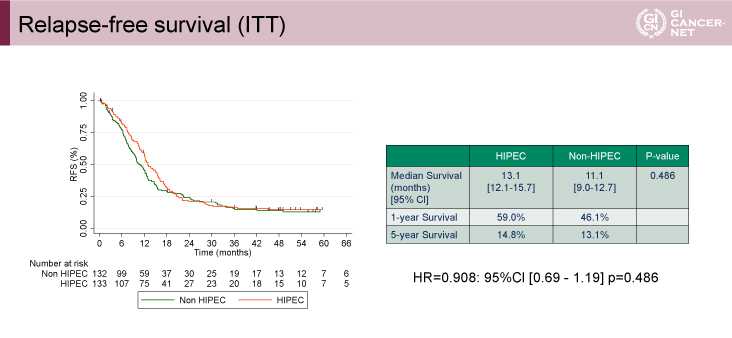
RFS期間の中央値は、HIPEC群13.1ヵ月、non-HIPEC群11.1ヵ月、HR=0.908(95% CI: 0.69-1.19、p=0.486)であり、OSと同様にHIPEC群の優越性は認められなかった(図2)。
図2 Relapse-free survival(ITT)(発表者の許可を得て掲載)
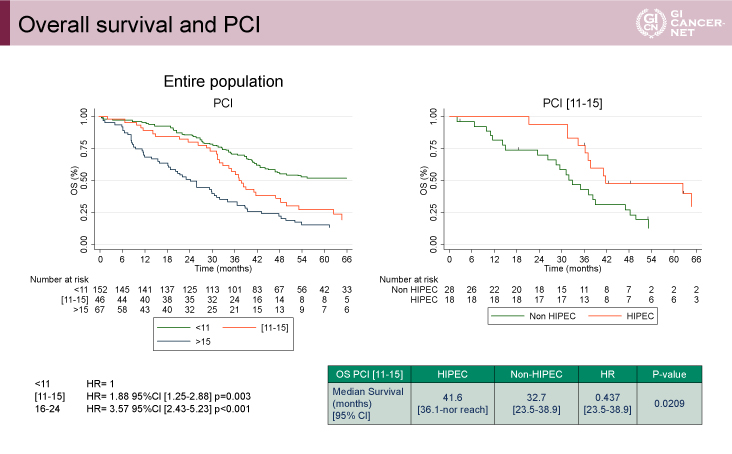
サブグループ解析では、PCIが11-15の患者におけるOS期間のMSTはHIPEC群41.6ヵ月、non-HIPEC群32.7ヵ月、HR=0.437(95% CI: 23.5-38.9、p=0.0209)であり、HIPEC群で良好な傾向を示した(図3右)。また、PCIが高いほどOS期間が短縮する傾向にあった(図3左)。
図3 Overall survival and PCI(発表者の許可を得て掲載)
60日以内の総死亡率は2.6%で、両群間に差は認められなかった(HIPEC群2例 vs. non-HIPEC群1例)。HIPEC群とnon-HIPEC群における30日以内に発現したGrade 3以上の有害事象は、消化管穿孔(10.5% vs. 6.1%)、腹膜出血(8.3% vs. 2.3%)が有意差はないものの、HIPEC群で高い傾向にあった。一方で、60日以内に発現したGrade 3以上の有害事象発現率はHIPEC群で有意に高かった[24.1% vs. 13.6%(p=0.030)]。
まとめ
腹膜播種を伴う切除不能進行・再発大腸癌に対して、HIPECを上乗せする効果は示されなかった。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 伊澤 直樹)
References
1) 大腸癌研究会:大腸癌治療ガイドライン医師用2016年版
2) Franko J, et al.: Lancet Oncol. 17(12): 1709-1719, 2016[PubMed]
3) Verwaal VJ, et al.: J Clin Oncol. 21(20): 3737-3743, 2003[PubMed]
4) Elias D, et al.: Ann Oncol. 13(2): 267-272, 2002[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科