結腸癌に対する術前補助化学療法(neoadjuvant chemotherapy)の意義を検討する国際無作為化比較試験(FOxTROT)
FOxTROT: an international randomised controlled trial in 1052 patients evaluating neoadjuvant chemotherapy for colon cancer
Matthew T. Seymour, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
通常、結腸癌は切除可能な場合にはまず切除し、その後、術後補助化学療法(adjuvant chemotherapy)を行うことが日本でも欧米でも標準的である。骨盤内に存在し、腫瘍量が多い場合の切除に難渋する直腸癌では、術前化学放射線療法(preoperative radiochemotherapy)や術前化学療法(preoperative chemotherapy)が検討されてきたが、結腸癌ではいままであまり検討されていなかった。しかし、有効な化学療法の発達やコンプライアンスの向上などにより、術前に化学療法を入れることのメリットが他癌種などで示されており、結腸癌において検討した試験がこのFOxTROTである。ちなみにFOX-TROTとは、社交ダンスのステップのひとつである。
術前に、FOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]療法あるいはCapeOx[Capecitabine+Oxaliplatin(OX):XELOX、RAS野生型に対しては+Panitumumab(Pmab)]療法を行うことで術後2年再発割合を8%下げることを期待した1,000例規模の試験は、結果的には想定した改善効果を示すことはできなかった。そのため、現時点でこの対象に対して術前化学療法を推奨する結果にはならなかった。
ただし、術前治療によりダウンステージが得られR0切除割合が向上し、周術期の合併症も低下、有意差は出なかったものの術後2年再発割合を減少させている。一部の症例に対してはメリットがある可能性があり、それは、ミスマッチ修復機構欠損(dMMR)のステータスや、RAS遺伝子、BRAF遺伝子のステータスにより絞り込みが可能かもしれない。本邦ではより高いR0切除割合が期待できるため、結果の解釈には慎重を要するが、今後の結腸癌に対する術前化学療法の有効性の可能性を示した試験であった。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
術前補助化学療法(neoadjuvant chemotherapy)は結腸癌に対して有効か?
再発リスクの高いStage IIもしくはStage III結腸癌に対してR0手術後に補助化学療法(adjuvant chemotherapy)を行うことは、標準治療として位置付けられている1,2)。
一方で、術前補助化学療法(neoadjuvant chemotherapy: NAC)は不完全切除リスクの低下や微小転移に対する治療を術後補助化学療法より早期に開始できることなどのメリットがあると考えられているが、結腸癌において有効性と安全性を検討した多数例での報告は少ない。
結腸癌に対する術前/術後補助化学療法群と術後補助化学療法群との無作為化比較試験
今回の試験対象は、消化管閉塞のない臨床病期T3-4、N0-2、M0で、手術可能な患者であり、術前/術後補助化学療法群(NAC 6週 → 手術 → 術後補助化学療法18週、以下NAC群)と、術後補助化学療法群(術後補助化学療法4週)に、2:1で無作為に割り付けられた。KRAS codon 12、13、61野生型の症例に対しては、Panitumumab(Pmab)が併用して投与された。
主要評価項目は術後2年再発割合であり(ITT集団)、副次評価項目は、完全切除割合、周術期の安全性、ダウンステージング割合、組織学的治療効果であった。
NAC群で周術期の有害事象の増加はなく、短期治療成績が向上
本試験には1,052例が登録され、75%が5cm以上のT4/T3であった。周術期の治療は両群とも、FOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]療法が72%、CapeOX[Capecitabine+Oxaliplatin(OX):XELOX]療法が28%であり、治療内容に差を認めなかった。安全性に関しては、NAC群では周術期の死亡割合の増加は認められず、再手術を要する合併症はNAC群で有意に低率(p=0.05)であり、縫合不全あるいは膿瘍形成割合なども低い傾向であった(p=0.07)(表1)。
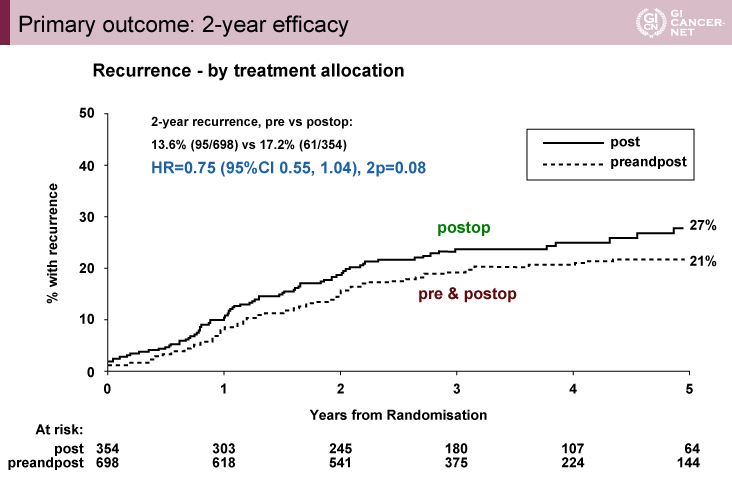
主要評価項目である術後2年再発割合は、NAC群13.6%、術後補助化学療法群17.2%であり、NAC群で低率であったが統計学的有意差は認められなかった[ハザード比(HR): 0.75、95% CI: 0.55-1.04、p=0.08](図1)。完全切除割合は、NAC群4.8%、術後補助化学療法群11.1%とNAC群で有意に低率であり(p=0.001)、ダウンステージング割合は、NAC群で有意に高率であった(p<0.0001)。
Pmab併用の治療効果を確認するサブ解析には279例が登録され、Pmab併用群では組織学的治療効果の向上は認められなかった(p=0.30)。後解析で探索的に行われたマイクロサテライト不安定性(microsatellite instability: MSI)ステータス別の組織学的治療効果の比較では、ミスマッチ修復機構欠損(dMMR)173例において有意に組織学的治療効果が得られない結果であった(p<0.0001)。
表1 Perioperative Complications(発表者の許可を得て掲載)
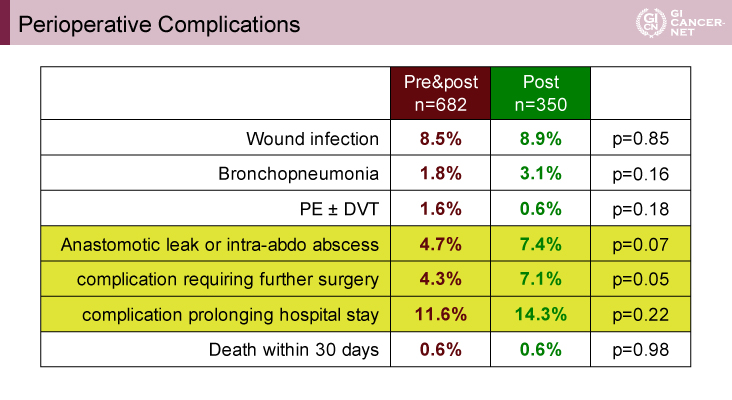
図1 Primary outcome results: 2-year efficacy(発表者の許可を得て掲載)
まとめ
NACは周術期の死亡率を増加させず、重篤な術後合併症は少ない傾向にあった。またNACを行った59%の症例で組織学的治療効果が認められ、ダウンステージング割合が上昇し、不完全切除割合の低下が認められた。一方で術後2年再発割合は改善したものの、統計学的有意差は認められなかった。
(レポート:がん研有明病院 消化器化学療法科 大隅 寛木)
References
1) 大腸癌研究会:大腸癌治療ガイドライン医師用2019年版,2019
2) NCCN: NCCN Guidelines. Colon Cancer, Version 2, 2019

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科