Durvalumab+Tremelimumab併用療法とBSC(best supportive care)を比較した第II相試験における血漿中MSIとTMBによる追加解析(CCTG CO.26試験)
CCTG CO.26: Updated analysis and impact of plasma-detected microsatellite stability (MSS) and tumor mutation burden (TMB) in a phase II trial of durvalumab (D) plus tremelimumab (T) and best supportive care (BSC) versus BSC alone in patients (pts) with refractory metastatic colorectal carcinoma (CRC)
Eric Xueyu Chen, et al.
監修コメント

谷口 浩也先生
国立がん研究センター東病院 消化管内科 医長
ASCO-GI 2019で報告されたCCTG CO.26試験の追加解析である。免疫チェックポイント阻害薬(ICI)単剤では治療効果が期待できないマイクロサテライト安定性(microsatellite stable: MSS)大腸癌に対して、抗PD-L1抗体薬に加えて抗CTLA-4抗体薬併用が試みられている。このDurvalumabとTremelimumabの併用は、同系統の他剤と比較して重篤な有害事象が少ないことも期待されている。
本追加解析では、マイクロサテライト不安定性(microsatellite instability: MSI)と腫瘍遺伝子変異数(tumor mutation burden: TMB)解析を行い治療効果がより期待される集団の絞り込みを試みている。結果としてTMB≧28mts/Mb(全体集団の21%)で、本併用療法が特に有効である可能性が示唆された。恣意的なカットオフ値の決め方であり、あくまで探索的な結果ではあるが、大腸癌で免疫療法が期待できる集団は現状これくらいの割合なのであろう。リキッドバイオプシーの手法でMSI statusとTMBが測定され、臨床効果や予後との相関が認められたことも興味深い。本研究で用いられたGuardant OMNIはコンパニオン診断医療機器としての開発も進んでいる。
本試験は第II相試験であり、より多数例での再現性を確認することが望まれる。MSS大腸癌に対する免疫療法のさらなる開発に期待したい。
(コメント・監修:国立がん研究センター東病院 消化管内科 医長 谷口 浩也)
マイクロサテライト安定性(microsatellite stable: MSS)大腸癌における免疫療法の治療効果予測バイオマーカーは同定されていない
PD-L1とCTLA-4の両者を標的とした治療は免疫療法の効果を増強させる可能性があり、CCTG CO.26試験において標準治療不応の切除不能進行・再発大腸癌(mCRC)を対象に、BSC(best supportive care)と比較して効果が評価された。MSS大腸癌における免疫療法の治療効果予測バイオマーカーは同定されておらず、本追加解析では、腫瘍遺伝子変異数(tumor mutation burden: TMB)の意義を検討した。
追加解析は、マイクロサテライト不安定性(microsatellite instability: MSI)とTMB
本試験では、標準治療[Fluorouracil(5-FU)、Oxaliplatin(OX)、Irinotecan(IRI)、Bevacizumab(Bmab)、Regorafenib(REG)、使用可能な場合はTAS-102、RAS野生型では抗EGFR抗体薬の治療歴]不応のmCRC症例が、2:1で、Durvalumab+Tremelimumab+BSC群(以下、D+T群)とBSC群に割り付けられた。
主要評価項目は全生存(OS)期間であり、BSC群に対してD+T群がハザード比(HR)0.65となることを仮説とし、両側p値<0.10が統計学的に有意と見積もられた。
Durvalumab 1,500mg投与/day 1を28日毎に繰り返し、最初の4サイクルはTremelimumab 75mg/day 1の投与が併用された。Guardant OMNIを用い、ベースラインにおける血漿中のcfDNAによってMSIとTMB解析が行われた。
抗PD-L1抗体薬と抗CTLA-4抗体薬の併用療法はMSS大腸癌の予後を改善、TMBも症例絞り込みに有効か
2016年8月から2017年6月までの間に、180例が登録された。観察期間中央値15.2ヵ月の時点で、OS中央値はD+T群6.6ヵ月、BSC群4.1ヵ月であった(p=0.07、HR=0.72、90% CI: 0.54-0.97)(図1)。無増悪生存(PFS)期間(副次評価項目)、病勢コントロール割合(DCR)はACSO-GI 2019で報告されており、PFS期間中央値は、D+T群1.8ヵ月vs. BSC群1.9ヵ月(HR=1.01、90% CI: 0.76-1.34)、DCRは同様に、22.7% vs. 6.6%(p=0.006)であった1)。
169例の血液サンプルが回収され、168例(99%)でcfDNAによるMSI statusが解析された。2例はMSI-High(MSI-H)であり、TMBは247.1mutations (mts)/Mbと74.7mts/Mbであった。166例はMSSで、TMBの平均値は20.4±16.3mts/Mb(幅:0.96-114.0)であった。
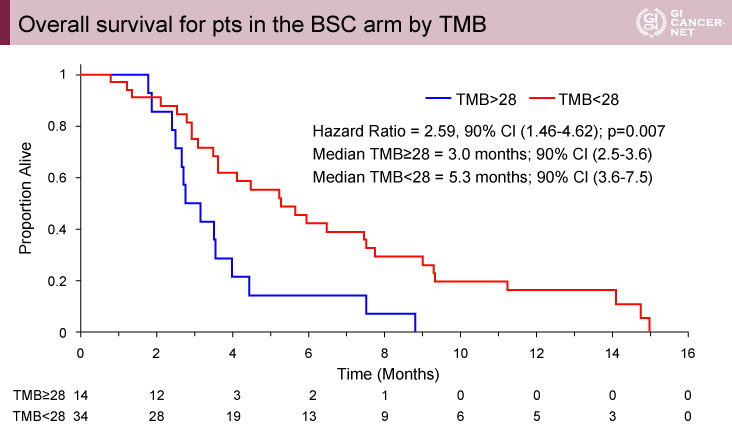
一般的に使用されることが多いTMB 20mts/MbでTMB highとlowに分類した場合、69例(42%)の症例がTMB>20であった。TMB 20をcut pointにした場合、D+T群のOSは有意な改善を認めなかった(interaction p>0.7)。minimum p-value approachにより、TMB≧28mts/Mbでは(MSS症例166例の21%、35例)、OS中央値はD+T群5.5ヵ月、BSC群3.0ヵ月であり、有意にD+T群でOS期間が良好であった(HR=0.34、90% CI: 0.18-0.963)(interaction p=0.07)(図2)。一方で、TMB<28mts/Mbの症例では、D+T群6.9ヵ月、BSC群5.3ヵ月であり、有意差を認めなかった(HR=0.76、90% CI: 0.53-1.09)(図3)。BSC群では、TMB≧28でOS中央値は3.0ヵ月、TMB<28で5.3ヵ月でありTMB-Hは予後不良であった(HR=2.59、90% CI: 1.46-4.62)(図4)。
図1 Overall survival(発表者の許可を得て掲載)
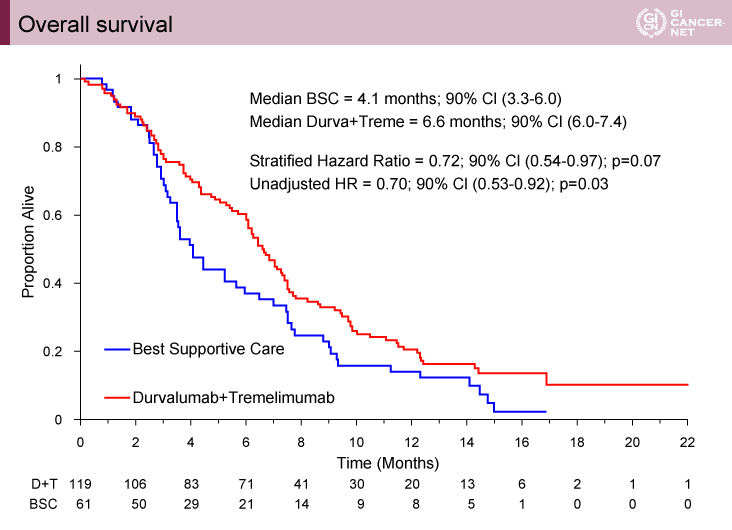
図2 Overall survival for pts with TMB≧28(発表者の許可を得て掲載)
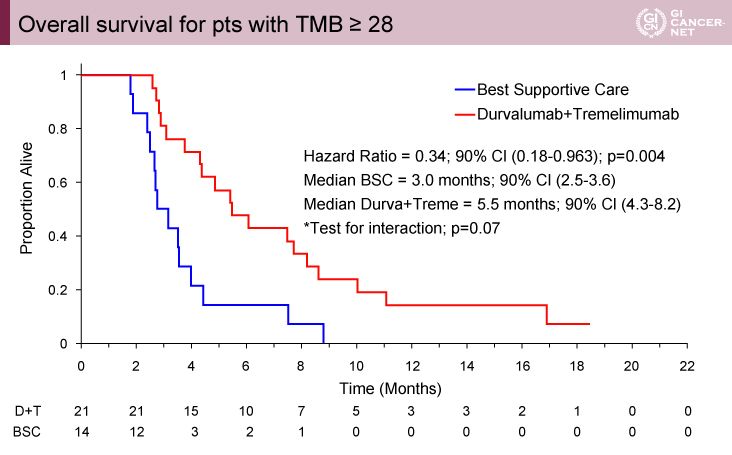
図3 Overall survival for pts with TMB<28(発表者の許可を得て掲載)
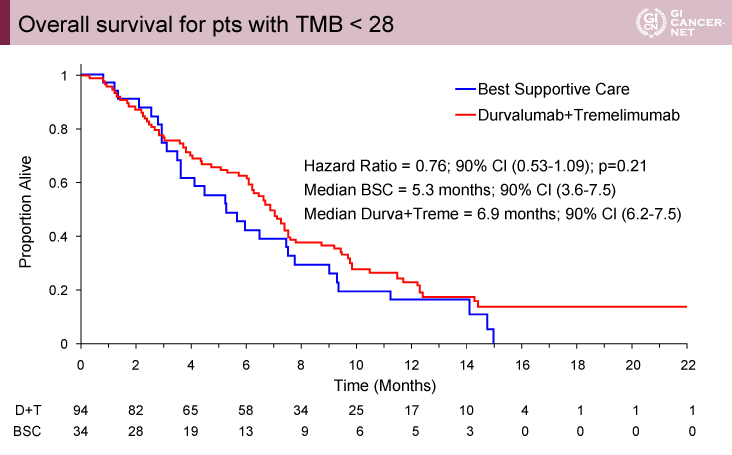
図4 Overall survival for pts in the BSC arm by TMB(発表者の許可を得て掲載)
まとめ
DurvalumabとTremelimumabの併用療法は、標準治療不応のmCRCにおいてBSCと比較してOS期間延長が認められた。MSS症例におけるTMB-Hは、DurvalumabとTremelimumabの併用療法効果をより期待できる集団であると考えられた。また、TMB-HはBSCにおける予後不良因子であった。
(レポート:北海道大学病院 消化器内科 川本 泰之)
Reference
1) Chen EX, et al.: J Clin Oncol. 37(4_suppl): 481-481, 2019[Journal of Clinical Oncology]
関連サイト
・CCTG CO.26試験[ClinicalTrials.gov]
・大腸癌のバイオマーカー[GI-pedia]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科