RAS野生型切除不能進行・再発大腸癌に対するmodified FOLFOXIRI+Panitumumab併用療法の無作為化第Ⅱ相試験(AIO-KRK-0109/VOLFI試験)
mFOLFOXIRI + Panitumumab versus FOLFOXIRI as first-line treatment in patients with RAS wild-type metastatic colorectal cancer (mCRC): A randomized phase II trial of the AIO (AIO-KRK-0109)
Michael Geissler, et al.
監修コメント
本試験において、FOLFOXIRIに対するPanitumumab併用の奏効割合への上乗せ効果が示された。併用療法における奏効割合は85.7%と非常に良好な成績で、本結果はFOFOXIRI+抗EGFR抗体薬併用療法における既報1-5)の70~80%台と同様な結果であり、再現性が得られたと考える。また、この奏効割合の上乗せ効果は、原発巣の部位やBRAF状況にかかわらず認められ、切除移行率も対象のFOLFOXIRI療法と比較して約2倍であった。これらの結果より、FOLFOXIRI+抗EGFR抗体薬併用療法の有効性は非常に期待できるものではあるが、有効性の評価項目の1つであるPFSは両群でほぼ同程度であり、奏効割合や切除移行率への上乗せが反映されていなかった。両群ともにプロトコール治療は最大12コースまでと規定されていたが、その後実際にどのような治療が行われていたかについては報告がなく、今後これらの後治療に関する情報、何よりもOSの報告が必要であろう。また、有害事象に関しては管理可能と報告されていたが、重篤な治療関連有害事象や重篤な消化器関連有害事象の頻度が有意にPanitumumab併用群で高く、これらのリスクに関する詳細な報告も必要である。
現在の切除不能進行・再発大腸癌の治療アルゴリズムには、TRIBE試験6)の結果よりFOLFOXIRI+Bevacizumab併用療法が標準治療の1つとして記載されている。FOLFOXIRIに対する最適な分子標的薬のパートナーがBevacizumabであるのか、それとも抗EGFR抗体薬であるのか、またはこれらの併用療法に伴うリスク-ベネフィットの違いは何であるのかに関しては、現在本邦で進行中のDEEPER試験7)が明らかにしてくれることを期待したい。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
FOLFOXIRI療法に対する分子標的薬の上乗せ効果を検証
FOLFOXIRIは、切除不能進行・再発大腸癌に対する殺細胞性抗癌剤のkey drugである5-FU、Oxaliplatin、Irinotecanの3剤を全て組み合わせた治療レジメンである。第III相試験においてFOLFIRI療法に対してOSや奏効割合で優越性を示し8)、Bevacizumab併用下においても同様にFOLFIRIに対する優越性が認められたため6)、FOLFOXIRIは現在標準レジメンの1つに位置づけられている。
一方で、さらなる奏効の上乗せを期待して、FOLFOXIRIと抗EGFR抗体薬の併用療法も検討されてきた1-5)。しかし、第I/II相試験で下痢を高頻度に認めたため、抗EGFR抗体薬との併用については、忍容性の観点から5-FUやIrinotecanの減量が必要である可能性が示唆された。
本試験は、5-FUとIrinotecanを減量したmodified FOLFOXIRI(mFOLFOXIRI)+Panitumumab併用療法とFOLFOXIRIを比較した無作為化第II相試験である。
奏効割合を主要評価項目としてmFOLFOXIRI+PanitumumabとFOLFOXIRIを比較
主な適格規準は、RAS野生型(2013年11月にKRAS野生型からRAS野生型へ変更)、ECOG PS 0-1の切除不能進行・再発大腸癌である。対象をmFOLFOXIRI+Panitumumab(6mg/kg)群とFOLFOXIRI群に2:1で無作為に割り付けられた。mFOLFOXIRIの用量は、当初Oxaliplatin 85mg/m2, Irinotecan 165mg/m2, 5-FU 3,000mg/m2 48時間持続静注, LV 200mg/m2に設定されたが、試験期間中にIrinotecanの用量が165mg/m2から130mg/m2または150mg/m2に変更され、最終的に大部分の症例は150mg/m2で投与された。また、FOLFOXIRIの用量は、Oxaliplatin 85?mg/m2, Irinotecan 165mg/m2, 5-FU 3,200mg/m2 48時間持続静注, LV 200mg/m2であり、mFOLFOXIRI、FOLFOXIRIいずれも12サイクルまでと規定されていた。なお、本試験では、Cohort1(切除の可能性がない大腸癌)とCohort2(腫瘍縮小により切除の可能性があると考えられる大腸癌)の2つのCohortに分けて検討された。
主要評価項目は奏効割合であり、副次評価項目は病勢コントロール割合、PFS、OS、安全性、QOLなどであった。奏効割合をmFOLFOXIRI+Panitumumab群75%超、FOLFOXIRI群60%以下と仮定し、両側α=5%、検出力80%で、mFOLFOXIRI+Panitumumab群の必要症例数は62例であった。
原発部位、BRAF statusに関わらずmFOLFOXIRI+Panitumumab群でORRが高い結果
2011年6月~2017年1月の間に105例が無作為化され、RAS変異型など不適格症例が除外された結果、96例がITT解析の対象となった(mFOLFOXIRI+Panitumumab群63例、FOLFOXIRI群33例)。なお、Cohort別の症例数は、Cohort1:mFOLFOXIRI+Panitumumab群43例、FOLFOXIRI群22例、Cohort2:mFOLFOXIRI+Panitumumab群20例、FOLFOXIRI群11例であった。
患者背景は両群間に大きな偏りはみられなかったが、右側原発がmFOLFOXIRI+Panitumumab群10例(15.9%)、FOLFOXIRI群8例(24.2%)であり、FOLFOXIRI群でやや多い傾向にあった。また、次世代シーケンサーにより解析可能であった76例(mFOLFOXIRI+Panitumumab群50例、FOLFOXIRI群26例)において、BRAF変異型はmFOLFOXIRI+Panitumumab群7例(14.0%)、FOLFOXIRI群9例(34.6%)であり、FOLFOXIRI群に多くみられた。
主要評価項目である奏効割合は、mFOLFOXIRI+Panitumumab群85.7%、FOLFOXIRI群60.6%であり、mFOLFOXIRI+Panitumumab群で有意に高かった(Odds ratio=3.900, 95% CI: 1.44-10.52, p=0.0096)。原発巣の部位別の奏効割合は、左側でmFOLFOXIRI+Panitumumab群90.6%、FOLFOXIRI群68.0%、右側でそれぞれ60.0%、37.5%、遺伝子変異別の奏効割合は、RAS/BRAF野生型で86.0%、64.7%、BRAF変異型で71.4%、22.2%であり、いずれもmFOLFOXIRI+Panitumumab群が高い結果であった。なお、Cohort2では、mFOLFOXIRI+Panitumumab群70.0%、FOLFOXIRI群36.4%で切除が実施され、R0切除率はそれぞれ50.0%、27.3%であった。
PFS中央値は、mFOLFOXIRI+Panitumumab群10.5ヵ月、FOLFOXIRI群10.8ヵ月であり、両群間で有意差は認められなかった(HR=1.107, 95% CI: 0.69-1.75, p=0.6634)(図)。
図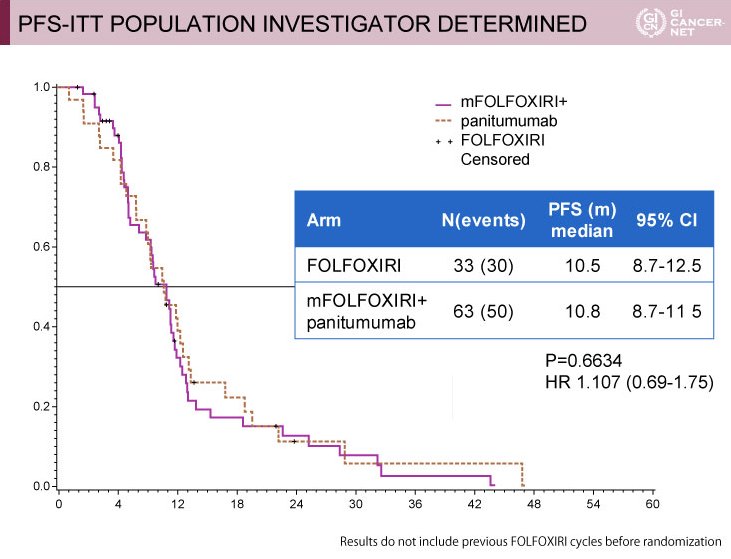
重篤な有害事象は、grade 3以上の消化器毒性がmFOLFOXIRI+Panitumumab群25%、FOLFOXIRI群3%と、mFOLFOXIRI+Panitumumab群で有意に多く認められ(p=0.0093)、治療関連有害事象は、それぞれ40.6%、18.2%であった(表)。
表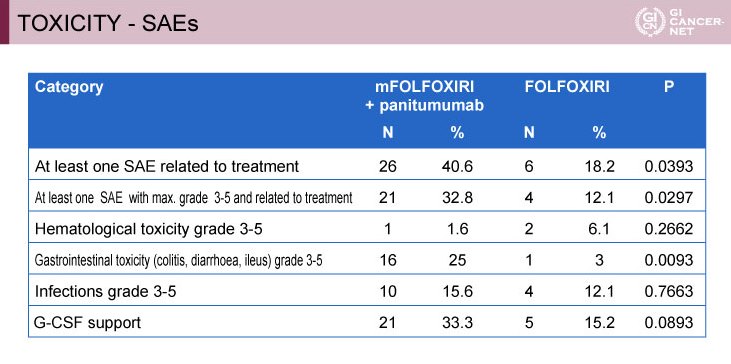
まとめ
modified FOLFOXIRI+Panitumumab療法は、主要評価項目である奏効割合で優越性を示し、R0切除率も高率であったが、PFSでは有意な延長を認められなかった。高い奏効割合とR0切除率がOSの延長につながるかどうか、今後追跡した結果の報告が待たれる。
(レポート:愛知県がんセンター中央病院 薬物療法部 三谷 誠一郎)
References
- 1) Garufi C, et al.: Br J Cancer. 103(10): 1542?1547, 2010[PubMed]
- 2) Saridaki Z, et al.: Br J Cancer. 107(12): 1932?1937, 2012[PubMed]
- 3) Fornaro L, et al.: Ann Oncol. 24(8): 2062?2067, 2013[PubMed]
- 4) Assenat E, et al.: Oncologist. 16(11): 1557?1564, 2011[PubMed]
- 5) Cremolini C, et al.: 2014 Annual Meeting of the American Society of Clinical Oncology®: abst # 3596.
- 6) Loupakis F, et al.: N Engl J Med. 371(17): 1609-1618, 2014[PubMed]
- 7) RAS野生型進行大腸癌患者におけるFOLFOXIRI+セツキシマブとFOLFOXIRI+ベバシズマブの最大腫瘍縮小率(DpR)を検討する無作為化第II相臨床試験[UMIN-CTR]
- 8) Falcone A, et al.: J Clin Oncol. 25(13): 1670-1676, 2007[PubMed]

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長