切除不能進行・再発大腸癌患者に対するRamucirumabの有効性に関する血管新生バイオマーカーの解析(RAISE試験より)
Analysis of angiogenesis biomarkers for Ramucirumab efficacy in patients with metastatic colorectal cancer from RAISE, a global, randomized, double-blind, phase 3 study
Josep Tabernero, et al.
監修コメント
切除不能進行・再発大腸癌の2nd-lineとしては、ML18147試験1)、RAISE試験2)、VELOUR試験3)の結果を受け、Bevacizumab、Ramucirumab、Afliberceptの3つの血管新生阻害剤が臨床で使用されている。そして今回、RAISE試験のバイオマーカー解析の結果、治療前の血中VEGF-D濃度がRamucirumabの治療効果を予測できる可能性が示された。興味深いのは、全体の約60%を占めるVEGF-D濃度が高い群ではRamucirumabの有効性が大きいのに対し、濃度が低い群(約40%)ではむしろRamucirumabのdetrimental effectを示唆する結果となったことである。
これまで多くの血管新生阻害剤の臨床試験においてバイオマーカーの探索が行われてきたが、芳しい結果は得られてない。血管新生阻害剤は複数の機序から抗腫瘍効果を発揮していることもその原因のひとつである。このような状況下、血管新生阻害剤で初めてバイオマーカーによる患者選択の可能性が示された意義は大きい。本報告はPoster Display Sessionではあったが、その聴衆の多さに今後の展開への期待が表れていた。体外診断薬の承認にはアッセイ系の確立、再現性の確認を含め課題が残されているが、治療前VEGF-D値による適切な血管新生阻害剤の選択が実現されることを期待したい。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
血管新生阻害剤Ramucirumabの治療効果予測は可能か?
切除不能進行・再発大腸癌に対する血管新生阻害剤の選択肢が増えるなか、その適切な患者選択を可能とする治療効果予測因子については現時点で明らかではない。
Ramucirumabは、VEGFファミリーの受容体であるVEGFR-2の細胞外ドメインに結合し、VEGF-A, C, DのVEGFR-2への結合を阻害する完全ヒト型IgG1モノクローナル抗体薬である。Ramucirumabは、フッ化ピリミジン系製剤、OxaliplatinおよびBevacizumab併用1st-line後に病勢進行を認めた切除不能進行・再発大腸癌患者を対象に、2nd-lineにおけるFOLFIRI+Ramucirumabの有効性および安全性をFOLFIRI+プラセボと比較検討した国際共同第III相試験(RAISE試験)において、主要評価項目であるOSで有意な延長を認めた(OS中央値:Ramucirumab群13.3ヵ月 vs. プラセボ群11.7ヵ月, HR=0.84, 95% CI: 0.73-0.98, p=0.0219)2)。今回、RAISE試験におけるRamucirumabの有効性アウトカムと相関を持つバイオマーカー探索の結果が報告された。
カットオフ値の検討およびその妥当性の検証
RAISE試験に参加した患者から採取された治療前の血漿および組織検体が解析された。サンドイッチ法による血中血管新生関連因子濃度(VEGF-C, D、可溶性VEGFR-1, 2, 3)およびIHC法によるVEGFR-2発現4)が評価され、有効性アウトカムとの相関が解析された。本研究ではアダプティブ試験デザイン5)が採用され、登録患者は探索セット(marker exploratory; ME)と検証セット(marker confirmatory; MC)に1:2で割り付けられた。OSおよびPFSの解析にはKaplan-Meier法が用いられ、Cox比例ハザードモデルにより層別因子で調整された各マーカーについて解析された。また、STEPP(subpopulation treatment effect pattern plot)解析6)によって、マーカーレベル毎の有効性が評価された。
VEGF-DがRamucirumabの治療効果予測因子となる
RAISE試験に登録された患者のうち80%を超える患者でバイオマーカー解析が可能であった。VEGF-Dのカットオフ値は、MEセットにおける多変量解析に基づき115pg/mLと推定され、MCセットによりその妥当性が認められた(OSにおける交互作用p=0.0107, PFSにおける交互作用p=0.0013)。
また、MEセットとMCセットを合わせたTR(full translational research)集団における解析が行われた。その結果、VEGF-D high例(≧115pg/mL)とVEGF-D low例(<115pg/mL)の間に患者背景の偏りはなかった。VEGF-D high例におけるOS中央値は、Ramucirumab群13.9ヵ月、プラセボ群11.5ヵ月であり、Ramucirumab群で有意に良好であった(HR=0.73, 95% CI: 0.60-0.89, p=0.0022)(図1)。一方、VEGF-D low例におけるOS中央値は、Ramucirumab群12.6ヵ月、プラセボ群13.1ヵ月であり、Ramucirumab群が有意に不良であった(HR=1.32, 95% CI: 1.02-1.70, p=0.0344)(図2)。
図1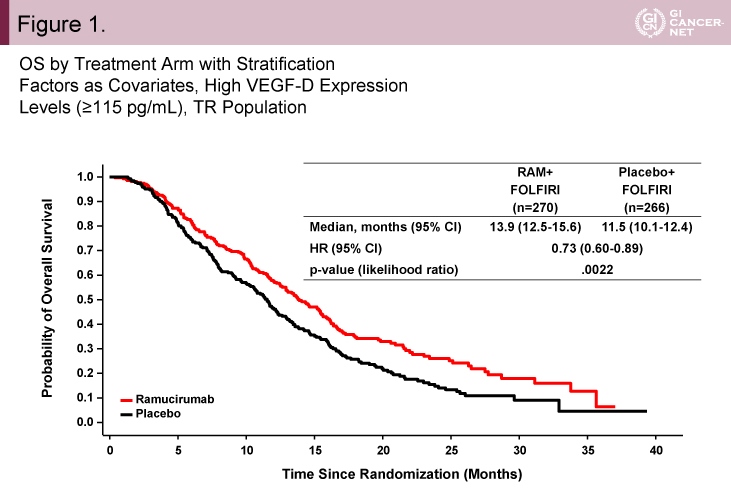
図2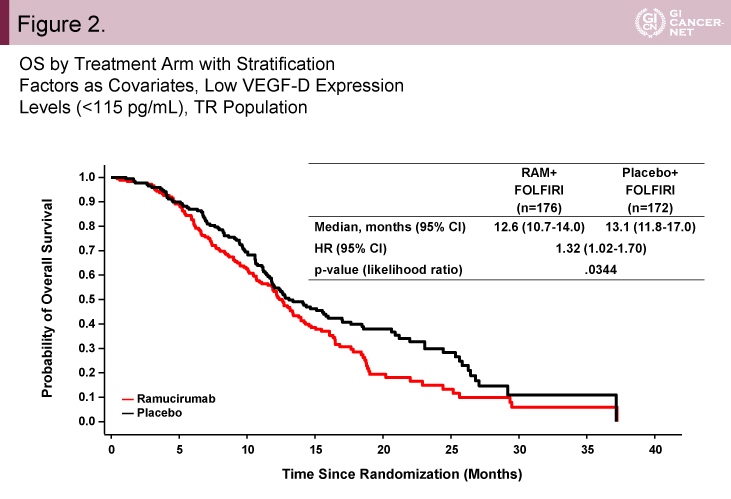
PFSについても、VEGF-D high例における中央値は、Ramucirumab群6.0ヵ月、プラセボ群4.2ヵ月(HR=0.62, 95% CI: 0.52-0.74, p<0.0001)、VEGF-D low例ではそれぞれ5.4ヵ月、5.6ヵ月(HR=1.16, 95% CI: 0.93-1.45, p=0.1930)であり、OSと同様の傾向が認められた。
STEPP解析では、OS、PFSともにVEGF-Dレベル毎のハザード比には一定の傾向がみられ、TR集団においても115pg/mLというカットオフ値が妥当であることが示された。
治療関連有害事象に関しては、VEGF-D high例とVEGF-D low例を比較すると、好中球減少がVEGF-D high例でRamucirumab群、プラセボ群いずれもやや多い傾向にあったが、他の有害事象について差はみられなかった。
まとめ
切除不能進行・再発大腸癌患者において、治療前の血中VEGF-D濃度はRamucirumabの治療効果予測因子となり得る可能性が示された。現在、臨床応用を目的としたアッセイの開発および検証が行われている。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 水上 拓郎)
References
- 1) Kubicka S, et al.: Ann Oncol. 24(9): 2342-2349, 2013[PubMed]
- 2) Tabernero J, et al.: Lancet Oncol. 16(5): 499-508, 2015[PubMed]
- 3) Van Cutsem E, et al.: J Clin Oncol. 30(28): 3499-3506, 2012[PubMed]
- 4) Holzer TR, et al.: PLoS One. 8(11): e80292, 2013[PubMed]
- 5) Freidlin B, Simon R: Clin Cancer Res. 11(21): 7872-7878, 2005[PubMed]
- 6) Bonetti M, Gelber RD: Stat Med. 19(19): 2595-2609, 2000[PubMed]

谷口 浩也 先生
愛知県がんセンター中央病院 薬物療法部 医長