HER2陽性胃癌(胃食道接合部癌を含む)に対するPertuzumab+Trastuzumab+化学療法の第III相試験(JACOB試験)の最終解析
Pertuzumab (P) + Trastuzumab (H) + chemotherapy (CT) for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (mGC/GEJC): Final analysis of a phase III study (JACOB)
Josep Tabernero, et al.
監修コメント
HER2陽性胃癌の開発は、常に先行する乳癌の成功の後に行われている。Trastuzumabについても、乳癌における成功の後に胃癌でもToGA試験1)でポジティブな結果をしめしたことで、 "HER2陽性癌"という括りで開発が可能ではないかということが言われた時期もあった。しかし、同時に病理の染色性の違いや胃癌組織中の不均一性、乳癌では予後因子であるが胃癌ではそうではないなど、いくつかの違いが指摘されてきた2)。TrastuzumabにEmtansineを結合させたT-DM1は、Trastuzumabとタキサン系製剤による治療歴のある乳癌患者に対してLapatinib+Capecitabineと比較したEMILIA試験において、有意に生存期間を延長した3)。一方、胃癌の2nd-lineにおいてTrastuzumab治療歴のある患者に対してタキサン系製剤とT-DM1を比較したGATSBY試験では、むしろT-DM1群で予後不良な傾向であった4)。
今回のPertuzumabも、乳癌の1st-lineを対象にしたCLEOPATRA試験においてTrastuzumabに対する有意な上乗せ効果を認めた5)。これが胃癌で再現されるかが注目されたが、結果としては残念な内容であった。Pertuzumab群で下痢の頻度が高かったものの、これにより治療中止の増加やdose intensityの低下は認めず、それぞれきちんと薬剤が入ったにもかかわらず、わずかに優越性が示せなかった格好である。また、HER2の染色性による有効性の違いもなく、その他のサブグループにおいても有効性の違いを示すものはなかった。これは純粋に薬剤のパワー不足と考えられ、胃癌の不均一性、HER2以外のシグナル経路の活性化の可能性などが考えられた。なお、その他の試験と異なり、日本人のサブグループで最も良好な生存期間を認めた理由は不明である。
マージナルな結果ではあったが、本試験は4,000名近くの胃癌患者をスクリーニングして行った試験であり、莫大な経費を費やしている。有用性を認めるサブグループも明らかでなく、HER2陽性胃癌に対してPertuzumabをこれ以上開発することは困難と思われた。現在Pertuzumabは、周術期化学療法に上乗せする形の臨床試験が行われている。現在開発中である、HER2抗体にトポイソメラーゼ阻害剤を結合させたDS-8201aが同対象への有望な結果を示しており6)、今後のHER2陽性胃癌の主役はそちらに移ることが予想される。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
HER2陽性乳癌で有意にOSを延長させたPertuzumab(HER2阻害薬)
PertuzumabはHER2を標的としたヒト化モノクローナル抗体である。HER2はHER3などと二量体を作成し増殖シグナルを伝達するが、PertuzumabがHER2に結合することでHER3などと二量体を形成できなくなる。さらに、HER2と結合した抗体はADCC活性によりリンパ球を介して癌細胞を攻撃し死滅させる。HER2陽性乳癌においては、Trastuzumab+化学療法にPertuzumabを上乗せすることでOSを有意に延長させることがCLEOPATRA試験などで報告されている5,7,8)。一方、HER2受容体を標的とした抗体であるTrastuzumabは、HER2陽性胃癌に対して化学療法へのOSの有意な上乗せ効果を認め1)、HER2陽性胃癌に対する標準治療となった。
HER2陽性乳癌とHER2陽性胃癌の仕組みはHER2発現のパターンなどで異なる可能性が示唆されているが9)、本試験では、HER2陽性乳癌と同様にHER2陽性胃癌においてもTrastuzumab+化学療法に対するPertuzumabの上乗せ効果を認めるかについて検証された。
Trastuzumab+化学療法に対するPertuzumabの上乗せ効果を検証
本試験は、二重盲検下無作為化第III相比較試験である。対象はECOG PS 0-1で、転移を有するHER2陽性(IHC 3+ or IHC 2+ and ISH陽性)胃癌/胃食道接合部癌患者であり、Pertuzumab(840mg: JOSHUA試験10)より設定)+Trastuzumab+化学療法を3週間毎に投与する群(P+H+CT群)とプラセボ+Trastuzumab+化学療法を3週間毎に投与する群(PLA+H+CT群)に1:1の割合で割り付けられた。なお、化学療法はCisplatin+5-FU/Capecitabineであり、層別因子として、地域(日本以外のアジア、日本、北アメリカ/西ヨーロッパ/オーストラリア、南アメリカ/東ヨーロッパ)、胃切除歴の有無、HER2免疫組織学スコア(IHC 3+ 、IHC 2+ and ISH陽性)が用いられた。
主要評価項目はOS、副次評価項目はPFS、奏効割合、安全性などであった。OSのハザード比を0.777、中央値をPLA+H+CT群15.0ヵ月、P+H+CT群19.3ヵ月と仮定し、検出力80%、両側α=5%で、必要イベント数は502であった。なお、最終データカットオフは2016年12月9日であった。
主要評価項目のOSはPertuzumabの上乗せ効果を示せず
2013年6月10日~2016年1月12日の間に780例が登録され、P+H+CT群388例、PLA+H+CT群392例に割り付けられた。患者背景は、胃癌/胃食道接合部癌がそれぞれ71.6%/28.4%、75.0%/25.0%、組織型(びまん型/腸型/その他)はそれぞれ4.6%/91.0%/4.4%、5.4%/89.3%/5.4%、HER2状況(IHC 2+ and ISH陽性/IHC 3+)は両群ともに33.2%/66.8%であった。Dose intensityは両群に差を認めなかったが、Pertuzumab(プラセボ)の投与サイクル数、Trastuzumabの投与サイクル数の平均値はいずれもP+H+CT群13.1サイクル、PLA+H+CT群11.2サイクルであり、P+H+CT群で多い傾向にあった。
OS中央値は、P+H+CT 群17.5ヵ月、PLA+H+CT群14.2ヵ月であり(HR=0.84, 95% CI: 0.71-1.00, p=0.0565)、有意差を示すことはできなかった(図1)。
図1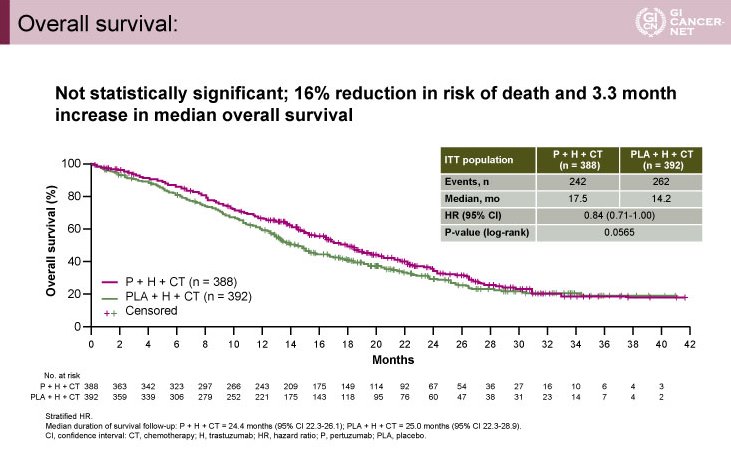
日本人サブグループは両群に40例ずつ割り付けされており、OS中央値はP+H+CT群22ヵ月、PLA+H+CT 群15.6ヵ月と良好な結果を示したが有意差は認めなかった(HR=0.65, 95% CI: 0.38-1.11)。また、原発部位、組織型、HER2状況などのサブグループ解析においても優越性を認められなかった。
PFS中央値はP+H+CT群8.5ヵ月、PLA+H+CT群7.0ヵ月であり(HR=0.73, 95% CI: 0.62-0.86)、P+H+CT群で良好な結果であった(図2)。
図2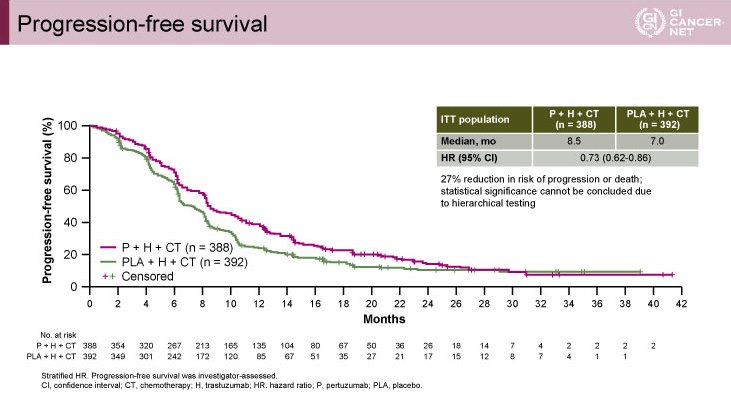
奏効割合は、P+H+CT群56.7%、PLA+H+CT群48.3%であり、P+H+CT 群で良好な傾向を認めた。
有害事象は、下痢(grade 3-5: P+H+CT群13.2%、PLA+H+CT群6.4%)、低カリウム血症(grade 3-5: P+H+CT群10.9%, PLA+H+CT 群 5.7%)がP+H+CT群で多い傾向にあった。なお、左室収縮機能障害は、両群ともに低頻度であり差を認めなかった。
まとめ
Trastuzumab+化学療法にPertuzumabを上乗せすることでOS中央値が3.3ヵ月延長し良好な傾向がみられたが、わずかに優越性を示すには至らなかった。また、全サブグループにおいても同様の傾向であった。副次評価項目のPFS、ORRにおいても同様な傾向であったが階層手法を用いたため有意な統計学的差は証明できなかった。安全性は下痢以外に両群間に差はなかった。
(レポート:東京慈恵会医科大学 消化器・肝臓内科 永田 祐介)
References
- 1) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010[PubMed]
- 2) 日本病理学会: 胃癌HER2病理診断ガイドライン
- 3) Verma S, et al.: N Engl J Med. 367(19): 1783-1791, 2012[PubMed]
- 4) Thuss-Patience PC, et al.: Lancet Oncol. 18(5): 640-653, 2017[PubMed]
- 5) Swain SM, et al.: N Engl J Med. 372(8): 724-734, 2015[PubMed]
- 6) Takegawa N, et al.: Int J Cancer. 141(8): 1682-1689, 2017[PubMed]
- 7) Baselga J, et al.: N Engl J Med. 366(2): 109-119, 2012[PubMed]
- 8) von Minckwitz G, et al.: N Engl J Med. 377(2): 122-131, 2017[PubMed]
- 9) Ruschoff J, et al.: Mod Pathol. 25(5): 637-650, 2012[PubMed]
- 10) Kang YK, et al.: Br J Cancer. 111(4): 660-666, 2014[PubMed]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長