複数がん種における早期発見を目的としたcell-free DNA(cfDNA:血漿中無細胞性DNA)解析[Circulating Cell-free Genome Atlas (CCGA) Study]
Plasma cell-free DNA (cfDNA) assays for early multi-cancer detection: the circulating cell-free genome atlas (CCGA) study.
Minetta C. Liu, et al.
監修コメント
近年のがん医療では、がんのゲノムプロファイルを治療選択に役立てるということが一般的になってきている。The Cancer Genome Atlas(TCGA)プロジェクトは、2006年より開始された大型がんゲノムプロジェクトで、20種類以上のがん組織を用いてゲノム、メチル化や、遺伝子蛋白発現について網羅的解析を行い、解析データも公開されている。それにより、分子標的治療薬の対象となるがん患者の割合やターゲットとすべき分子などの情報が抽出されたり、ゲノムによるサブグループが設定されたりするなど、治療開発に利用されている。しかし、がんの生物学的特性を示すゲノム情報はその時々で変化し、いったんは薬剤の効果がみられても耐性細胞のみが残ることで、まったく別の形質のがん細胞を相手に治療をしないといけなくなる。しかし、そのつど患者の身体からがん組織を採取することは多くの場合困難であり、かつ、患者に負担となる。そこで近年、患者の血液中に含まれるがん細胞からのシグナルを分析することでその時点のがんの形質を分析し、診断や治療に役立てる試みが急速に進歩している。この試みを「リキッドバイオプシー」と呼び、マイクロリボ核酸(マイクロRNA)や末梢血循環腫瘍細胞(CTC)を用いたりするものも含まれるが、もっとも臨床に近いのが末梢血の腫瘍由来のDNA断片(cell-free DNA: cfDNA)を用いたものである。
今回の発表であるCCGA Study(Circulating Cell-free Genome Atlas Study)は、TCGAプロジェクトのリキッドバイオプシー版として大いに注目された。1万5,000例もの末梢血cfDNAを測定するプロジェクトの途上において2,800例の解析結果が報告され、がんと非がん患者の判定に高い感度を示している。今回の検討はがん患者のほうが多い設定だが、実際の早期診断の場面では、患者が1,000人いてがん患者が1、2人いるかいないかというものを見分ける感度が必要であり、高い感度で見分ける手法が必要である。また、このような試験によるデータの蓄積により、抗がん剤の治療効果とcfDNAの関連を調べることができれば、耐性遺伝子の確認と、新たな生検をせずとも次の治療選択が有利になる可能性を示唆した。
いずれにしても途上のプロジェクトではあるが、今後の展開が注目される演題であった。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
縦断的コホート研究:CCGA Study(Circulating Cell-free Genome Atlas Study)
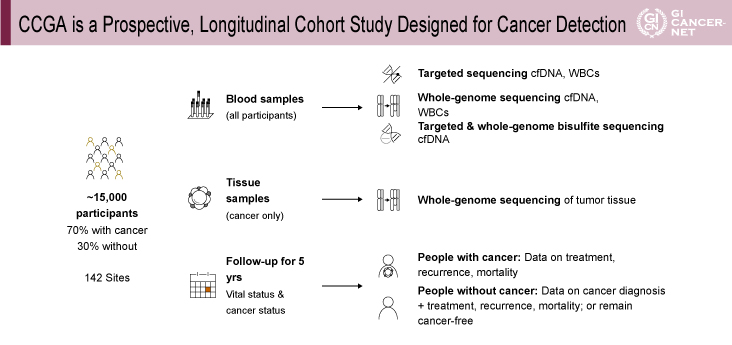
多くのがん種において、より進行したstageでは死亡率が高いことが報告されている1)。 CCGA Studyはさまざまながん種における早期発見を目的とした、cell-free DNA(cfDNA)を用いた検査系確立のための縦断的コホート研究である2)(図1)。総被検者数は1万5,000例(がん患者70%、非がん患者30%)で、血液検体と組織検体を解析し5年間の追跡を行う。血液検体の解析法として、target sequence、whole genome sequence、targeted and whole-genome bisulfite sequence、の3つのプロトタイプ分析系が採用されている。
図1 CCGA is a prospective, longitudinal cohort study designed for cancer detection(発表者の許可を得て掲載)
対象と方法
本研究においては、CCGA Studyの全1万5,000例のうち2,800例(がん患者1,628例、非がん患者1,172例)の血液検体を用い、事前計画に従い、training set(1,785例)とtest set(1,010例)に振り分けを行ったうえで、上記3つの分析系target sequence(Targeted: 60,000X depth)、whole genome sequence(WGS: 30X depth)、targeted and whole-genome bisulfite sequence(WBGS: 30X depth)によって解析がなされた。患者背景、がんのstage、診断法のいずれにおいても良好な割り付けが行われた。がん種としては乳がん、肺がん、前立腺がん、大腸がんの割合が多かった。
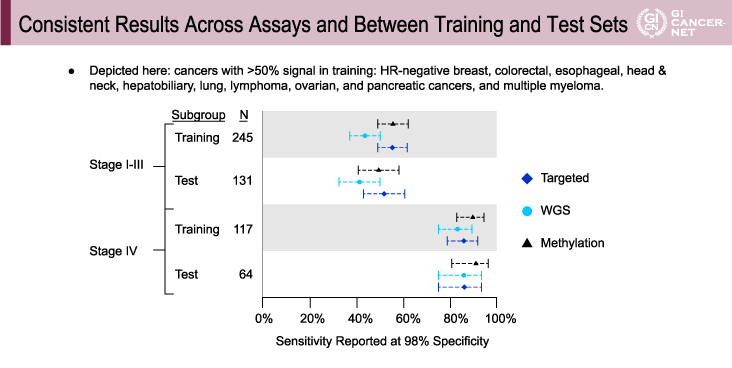
いずれのstage、検査系、setにおいても一貫した結果が得られた
変異の大部分(非がん患者の98%、がん患者の71%)が白血球由来のクローン性造血由来であり、年齢と正の相関関係を示した。これは腫瘍由来と誤る要因となりうるため、スクリーニング検査を行う際(特にtarget sequence)において注意を要した。
Training set、test setのいずれにおいても高い特異度(>99%)が実現可能であった。また、全体の結果としていずれのstage(I~III vs. IV)、検査系(Targeted vs. WGS vs. WBGS)、set(training set vs. test set)においても一貫した結果が得られた(図2)。
図2 Consistent results across assays and between training and test sets(発表者の許可を得て掲載)
全体的な検出率は、本検査系は複数のがん種においてスクリーニングとして進行がんのみならず比較的早期のがんも検出し、検出された症例の45%がstage IまたはIIであった。検出されたこれらのがん種の多くはスクリーニング方法がないか、もしくはあっても認められていないがん種(肺がん、食道がん、肝胆道がん、卵巣がん、膵がんなど)であり、死亡率も高いがん種である3)。
個別のがん種としては、ホルモン受容体陰性乳がんにおいてはstage IまたはIIにおいてstage IIIまたはIVと同等の検知率を認め、ホルモン受容体陰性乳がん全体(22例)のうち68%がtriple-negative乳がんであった。肺がんにおいては93%(43/46例)の被検者において喫煙歴があったが、喫煙歴なしの被検者と同等の検出感度を認めた。また、組織型の相違についても一貫した検出率[小細胞がん100%(5例)、扁平上皮がん65%(11例)、腺がん60%(12例)]を認めた。大腸がんにおいては原発部位についても一貫した検出率[直腸63%(10例)、左側結腸63%(5例)、右側結腸60%(6例)、その他60%(3例)]を認めた。
がん患者検体の診断法別にみると、スクリーニングによって診断された症例と臨床所見によってのみ診断された症例において比較を行った結果、後者において検出される傾向が強かった。
まとめ
複数のがん種で、また早期を含むすべてのstageにおいて、cfDNAベースの検査でがんを検出することが可能であった。Training setではtest setに対して再現性が保たれ、高い特異度(>99%)を認めた。Target sequenceにおいてはクローン性造血に留意する必要があるが、本研究はearly stageを含む複数のがん種の検知に有望な手法といえる。今後さらなる開発のために、CCGA Study本体を含む大規模研究が進行中である。
(レポート:がん研有明病院 消化器化学療法科 医員 鈴木 健)
References
- 1) SEER18 ages 50+ diagnosed 2006-2015. Surveillance, Epidemiology, and End Results (SEER) Program (http://www.seer.cancer.gov) SEER*Stat Database: Incidence - SEER 18 Regs Research Data, Nov 2017 Sub.
- 2) CCGA Study[ClinicalTrials.gov]
- 3) 5-year cancer-specific mortality rates for persons aged 50-79 from SEER18, 2010-2014; https://seer.cancer.gov.
関連サイト
- ・The Cancer Genome Atlas(TCGA)プロジェクト[cancergenome.nih.gov]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長