HIGHSOX試験:HER2陽性切除不能進行再発胃癌に対するS-1+Oxaliplatin+Trastuzumab(SOX+Tmab)併用療法の第II相臨床試験
KSCC/HGCSG/CCOG/PerSeUS1501B試験の最新解析:HER2陽性切除不能進行再発胃癌に対するS-1+Oxaliplatin+Trastuzumab(SOX+Tmab)併用療法の第II相臨床試験
監修コメント
本邦におけるHER2陽性切除不能進行再発胃癌に対するSOX[Oxaliplatin(OX)130mg/m2)]+Trastuzumab(Tmab)療法の有効性と安全性を検討する第II相試験であるHIGHSOX試験1)およびKSCC/HGCSG/CCOG/PerSeUS1501B試験2)の結果が報告され、いずれの試験も主要評価項目の統計学的な設定を達成した。2試験は別々の第II相試験であるため、有効性の指標である奏効割合(RR)、無増悪生存(PFS)、全生存(OS)、および安全性の指標である有害事象発現割合は両試験で若干異なるものの、既報と比較して有効性、安全性は十分に確認されたと考える。
G-SOX試験(OX 100mg/m2)では、grade 3以上の血小板数減少が10.1%に認められたのに対し3)、HIGHSOX試験では1.3%、KSCC/HGCSG/CCOG/PerSeUS1501B試験では17.9%であった。切除不能進行再発大腸癌初回治療例を対象にしたSOX(OX 130mg/m2)+Bevacizumab(Bmab)療法のmFOLFOX6+Bmab療法に対する非劣性を検証したSOFT試験と同様に4)、両試験とも、次コース開始予定日に血小板数が7.5万~10万/uLの場合でもOXの減量を行うという早めの減量基準が設定されていた。また末梢神経障害に関しては、G-SOX試験ではgrade 3以上が4.7%であったのに対し、HIGHSOX試験では16.0%、KSCC/HGCSG/CCOG/PerSeUS1501B試験では5.1%であった。KSCC/HGCSG/CCOG/PerSeUS1501B試験において末梢神経障害の発現頻度が低かった理由として、同試験では末梢神経障害grade 2を認めた段階でOXを1段階減量する減量基準が設けられていたことが考えられる。
今後、同療法を実地診療で行う際には、両試験の減量休薬基準をよく確認することが必要である。また今回の報告では、relative dose intensity(相対用量強度:RDI)や減量割合に関する報告は含まれておらず、今後の報告が待たれる。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
#667P
A phase II study of Trastuzumab with S-1 plus Oxaliplatin for HER2-positive advanced gastric cancer (HIGHSOX).
Keisho Chin, et al.
#668P
Updated analysis of a phase II study of SOX plus trastuzumab for the patients with HER2 positive advanced or recurrent gastric cancer: KSCC/HGCSG/CCOG/PerSeUS1501B.
Satoshi Yuki, et al.
HER2陽性胃癌に対する抗HER2療法の検討
HER2陽性胃癌初回治療例を対象としたToGA試験において、Capecitabine+Cisplatin(XP)療法または5-FU+Cisplatin(FP)療法へのHER2阻害薬Trastuzumab(Tmab)併用は全生存(OS)を有意に延長し、同対象に対するXP+Tmab療法は本邦ガイドラインでも推奨されるレジメン(エビデンスレベルA)として掲載されている5)。また、S-1+Cisplatin(SP)+Tmab療法も2つの第II相試験で再現性のある有効性、安全性が示されており6,7)、推奨されるレジメン(エビデンスレベルB)として掲載されている。一方、S-1+Oxaliplatin(SOX)+Tmab療法は、Cisplatinが使用できない場合など条件つきで推奨されるレジメンとされている。HIGHSOX試験、KSCC/HGCSG/CCOG/PerSeUS1501B試験はともに、このSOX+Tmab療法の有効性、安全性を検討した多施設共同第II相試験である。
HIGHSOX試験の主要評価項目は奏効割合(RR)
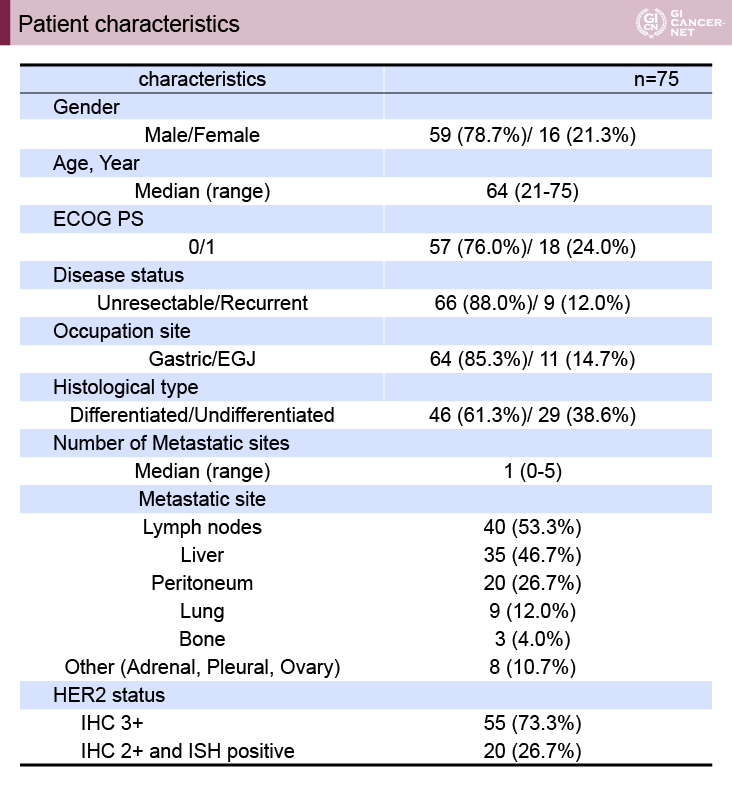
対象は20歳以上から75歳以下の男女で、ECOG PS(performance status)0/1のIHC3+またはIHC2+かつFISH陽性のHER2陽性切除不能進行再発胃癌患者であった。治療スケジュールは21日を1コースとし、S-1 80mg/m2を1日2回(朝、夕)2週間経口投与後7日間休薬、Tmabは初回コース8mg/kg(体重)、以降6mg/kg(体重)を、OXは130mg/m2を、それぞれday 1に点滴静脈内投与し、3週毎に繰り返した。
主要評価項目は奏効割合(RR)、副次評価項目は無増悪生存(PFS)、全生存(OS)、安全性であった。SOX+Tmab療法の閾値RRを50%、期待RRを65%と仮定し、片側α=0.1、検出力0.9、不適格例を考慮して必要症例数は75例に設定された(表1)。
表1 HIGHSOX試験におけるPatients characteristics(発表者の許可を得て掲載)
KSCC/HGCSG/CCOG/PerSeUS1501B試験も同様の主要評価項目
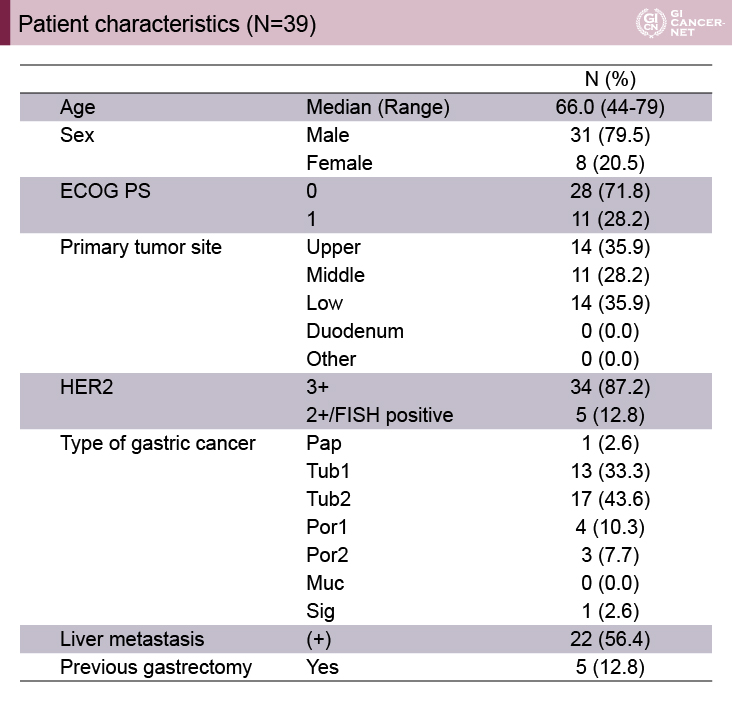
対象は20歳以上80歳未満の男女で、ECOG PS 0/1のIHC3+またはIHC2+かつFISH陽性のHER2陽性切除不能進行再発胃癌患者で、治療スケジュールはHIGHSOX試験と同様であった。主要評価項目はRR、副次評価項目はPFS、OS、time to treatment failure(TTF:治療成功期間)、治療期間、time to failure of strategy(TFS)、用量強度、安全性であった。SOX+Tmab療法の閾値RRを50%、期待RRを70%と仮定し、片側α=0.05、β=0.2、10%の脱落を考慮して必要症例数は40例に設定された(表2)。
表2 KSCC/HGCSG/CCOG/PerSeUS1501B試験におけるPatients characteristics(発表者の許可を得て掲載)
主要評価項目である奏効割合(RR)はそれぞれ70.7%、82.1%で、統計学的な設定を達成
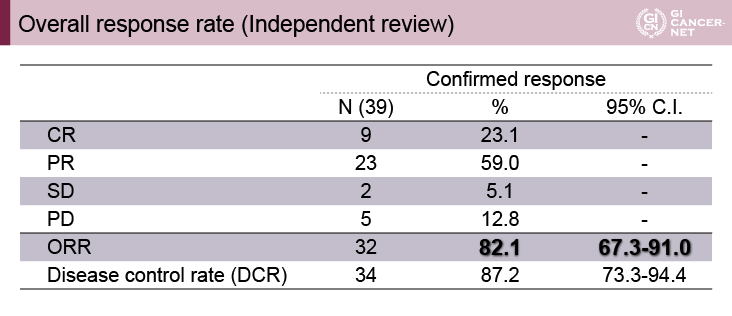
HIGHSOX試験におけるRRは70.7%(95% CI: 59.0-80.6)、KSCC/HGCSG/CCOG/PerSeUS1501B試験におけるRRは82.1%(95% CI: 67.3-91.0)であり、いずれも主要評価項目の統計学的な設定を達成した(表3、表4)。
表3 HIGHSOX試験におけるRR(発表者の許可を得て掲載)
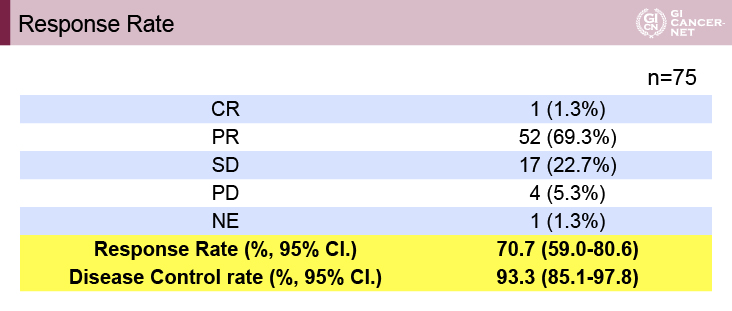
表4 KSCC/HGCSG/CCOG/PerSeUS1501B試験におけるRR(発表者の許可を得て掲載)
副次評価項目である無増悪生存(PFS)中央値はそれぞれ8.8ヵ月、7.0ヵ月、全生存(OS)中央値はそれぞれ18.1ヵ月、27.6ヵ月
HIGHSOX試験におけるPFS中央値は8.8ヵ月(95% CI: 7.4-12.2)、6ヵ月PFS 68.5%、12ヵ月PFS 39.5%であり、OS中央値は18.1ヵ月(95% CI: 15.6-26.5)、12ヵ月OS 77.2%、24ヵ月OS 43.0%であった。
KSCC/HGCSG/CCOG/PerSeUS1501B試験におけるPFS中央値は7.0ヵ月(95% CI: 5.5-14.1)、OS中央値は27.6ヵ月(95% CI: 15.6-)であった。また、同試験の副次評価項目であるTTF中央値は5.7ヵ月(95% CI: 4.6-7.0)であった。
主な有害事象
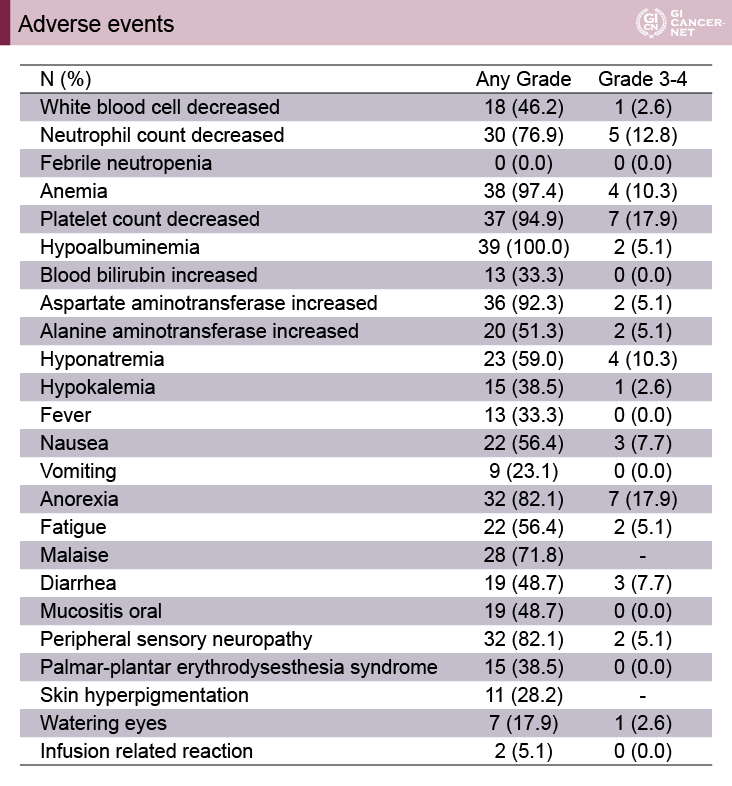
主な有害事象は、grade 3-4の血液毒性として、HIGHSOX試験、KSCC/HGCSG/CCOG/PerSeUS1501B試験それぞれにおいて、好中球減少は8例(10.7%)、5例(12.8%)、貧血は5例(6.7%)、4例(10.3%)、血小板減少は1例(1.3%)、7例(17.9%)に認められたが、いずれの試験でも発熱性好中球減少症は認められなかった。Grade 3-4の頻度の高かった非血液毒性として、HIGHSOX試験、KSCC/HGCSG/CCOG/PerSeUS1501B試験それぞれにおいて、下痢は5例(6.7%)、3例(3.7%)、食欲不振は4例(5.3%)、7例(17.9%)、悪心は3例(4.0%)、3例(7.7%)に認められた。また、末梢神経障害はそれぞれにおいて、全gradeでは63例(84.0%)、32例(82.1%)に、grade 3-4では12例(16.0%)、2例(5.1%)に認められた(表5、表6)。
表5 HIGHSOX試験における主な有害事象(発表者の許可を得て掲載)
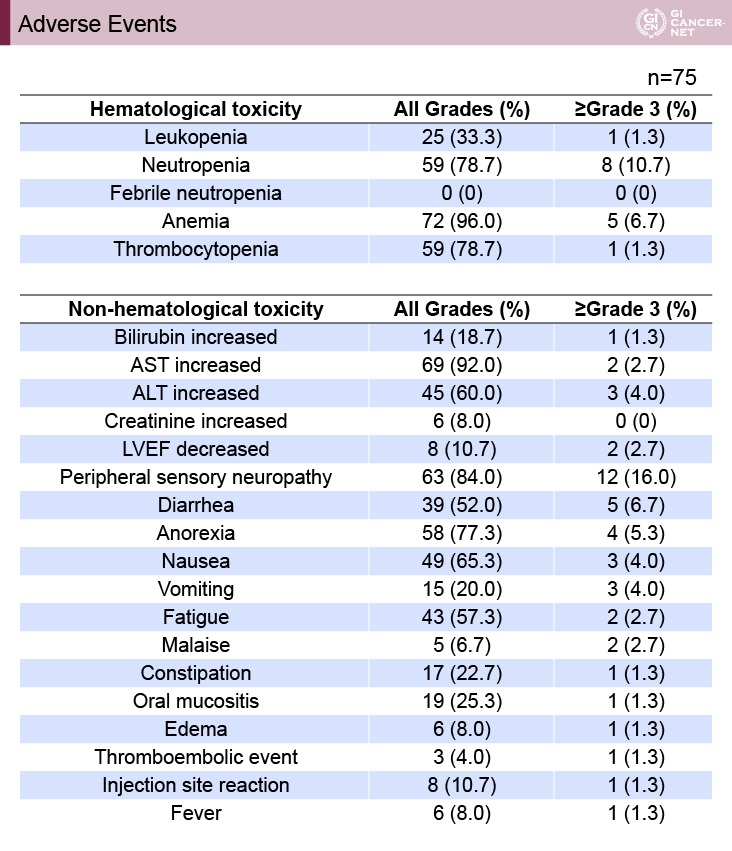
表6 KSCC/HGCSG/CCOG/PerSeUS1501B試験における主な有害事象(発表者の許可を得て掲載)
まとめ
HER2陽性切除不能進行再発胃癌に対する1次治療としてのSOX+Tmab併用療法は、有効性、安全性ともに良好な成績を示し、同患者に対する有望なレジメンと考えられる。
(レポート:静岡県立静岡がんセンター 消化器内科 レジデント 白数 洋充)
References
- 1) HER2陽性切除不能進行再発胃癌に対するS-1+Oxaliplatin+Trastuzumab(SOX+Tmab)併用療法の第II相臨床試験[UMIN-CTR]
- 2) 化学療法未治療のHER2陽性進行・再発胃癌に対するOxaliplatin+S-1+Trastuzumab併用療法について検討する第II相臨床試験 (KSCC/HGCSG/CCOG/PerSeUS1501B)[UMIN-CTR]
- 3) Yamada Y, et al.: Ann Oncol. 26(1): 141-148, 2015[PubMed][論文紹介]
- 4) Yamada Y, et al.: Lancet Oncol. 14(13): 1278-1286, 2013[PubMed]
- 5) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010[PubMed][論文紹介]
- 6) Kurokawa Y, et al.: Br J Cancer. 110(5): 1163-1168, 2014[PubMed]
- 7) Miura Y, et al.: Gastric Cancer. 21(1): 84-95, 2018[PubMed]

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長