BRAF野生型切除不能進行・再発大腸癌(mCRC)初回治療に対するフッ化ピリミジン系薬剤+Bevacizumab±Atezolizumab療法[バイオマーカー別の維持療法に関する多施設共同無作為化比較試験(MODUL試験)]
Fluoropyrimidine (FP) + bevacizumab (BEV) + atezolizumab vs FP/BEV in BRAFwt metastatic colorectal cancer (mCRC): Findings from cohort 2 of MODUL ? a multicentre, randomized trial of biomarker-driven maintenance treatment following first-line induction therapy.
Axel Grothey, et al.
監修コメント
本MODUL試験は、切除不能進行・再発大腸癌初回治療を対象に導入化学療法後のバイオマーカー別の維持療法の有効性を検討する多施設共同無作為化試験である。アンブレラ型の試験デザインを採用しており、BRAF変異型コホート、BRAF野生型コホート、HER2陽性コホートなどが設けられており、有望なバイオマーカーがあれば、さらにコホートが追加される予定となっている。本試験は、新規薬剤を維持療法の段階、つまり一次治療の段階で有効性を検討することが可能という点において新規性を有している。従来、新規薬剤の評価は標準治療に不応となった対象に行われることが多かったが、こういったいわゆるheavily treatedな対象が臨床的、生物学的にその薬剤の有効性を正しく評価するのに適しているかどうかは明らかではない。腫瘍量が少なく、分子生物学的に特定の遺伝子変異を有するクローンが残存していると考えられる維持療法の段階において有効性を評価することで、新規薬剤本来の有効性を過小評価してしまうリスクを回避できるというのが本試験の特徴である。
今回報告されたコホート2はマイクロサテライト安定性(microsatellite stable: MSS)大腸癌症例が大半を占めており、MSS大腸癌に対する免疫チェックポイント阻害薬の有効性を検討したという一面もある。MSS大腸癌は、マイクロサテライト不安定性(high-frequency microsatellite instability: MSI-H)大腸癌と比較し、免疫反応が十分に誘導されず免疫チェックポイント阻害薬が奏効しにくいとされている。そのため、MSS大腸癌における腫瘍性抗原提示能を上昇させるべく、ほかの薬剤との併用療法が開発されてきたが、そのひとつであるMEK阻害薬のCobimetinibと抗PD-L1抗体薬のAtezolizumab併用療法の有効性は無作為化第III相試験(COTEZO試験)で証明することできなかった1)。
今回のMODUL試験コホート2の試験治療群は、フッ化ピリミジン系薬剤+Bevacizumab(Bmab)とAtezolizumabの併用療法であり、Bmabに代表される血管新生阻害薬は樹状細胞の分化誘導、増殖の促進効果や制御性T細胞の抑制作用を有することから、免疫チェックポイント阻害薬の併用相手として期待されていた2)。しかし、本試験において血管新生阻害薬と免疫チェックポイント阻害薬併用の有効性を示すことはできず、MSS大腸癌に対する免疫療法の開発の難しさを再認識する結果となった。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
マイクロサテライト安定性(MSS)切除不能進行・再発大腸癌に対する、血管新生阻害薬(抗VEGF抗体薬)と免疫チェックポイント阻害薬併用療法の可能性の探索
切除不能進行・再発大腸癌の約95%がマイクロサテライト不安定性(high-frequency microsatellite instability: MSI-H)を有さないMSS(microsatellite stable)大腸癌であると報告されており、MSS切除不能進行・再発大腸癌に対して抗PD-1/PD-L1抗体薬単剤では有効性を示すことができなかった3)。
血管新生阻害薬(抗VEGF抗体薬)のBevacizumab(Bmab)と抗PD-L1抗体薬のAtezolizumabの併用が、VEGFにより誘発される免疫抑制に拮抗し、腫瘍へのT細胞の遊走を促進することが報告されている4)。
バイオマーカー別に個別化された維持療法の有効性を検討
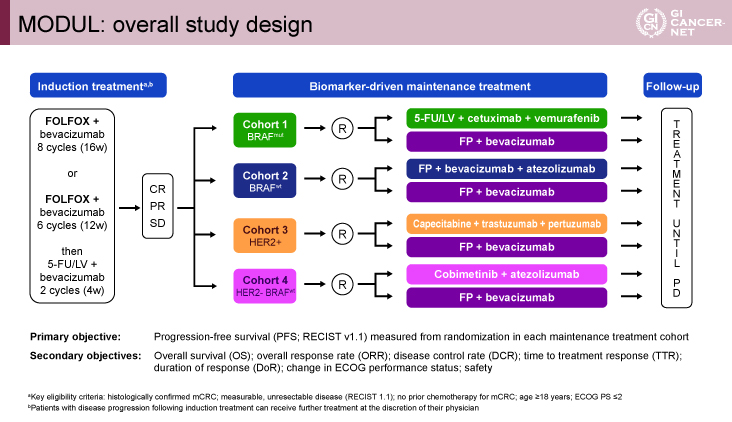
MODUL試験は、切除不能進行・再発大腸癌初回治療例に対する導入化学療法後のバイオマーカー別に個別化した維持療法の有効性を検討する、アンブレラ型の多施設共同無作為化第II相比較試験である。対象は18歳以上、ECOG PS(performance status)0-2の前化学療法歴のない切除不能進行・再発大腸癌患者であった。対象患者には登録後、導入化学療法としてFOLFOX+Bmab療法を8サイクル(16週)、もしくは、FOLFOX+Bmab療法を6サイクル(12週)後に5-FU+Leucovorin(LV)+Bmab併用療法を2サイクル(4週)実施され、完全奏効(CR)、部分奏効(PR)、安定(SD)であった症例が、バイオマーカー別の維持療法コホートとして試験治療群と標準治療群に2:1で無作為化された。いずれの維持療法コホートも標準治療群はフッ化ピリミジン系薬剤+Bmab療法であり、今回報告されたBRAF野生型症例を対象としたコホート2の試験治療群は、抗PD-L1抗体薬のAtezolizumabを併用した、フッ化ピリミジン製剤+Bmab+Atezolizumab(800mg/body)療法であった(図1)。
主要評価項目は、無増悪生存(PFS)期間、副次評価項目は全生存(OS)期間、全奏効割合(ORR)、病勢制御割合(DCR)、無作為化から初回奏効までの期間(time to response: TTR)、奏効期間(DR)、ECOG PSの変化、安全性であった。試験治療群のPFS期間を11.5ヵ月、標準治療群のPFS期間を7.5ヵ月[ハザード比(HR)=0.65]、両側α=0.05、検出力90%の設定で、必要なイベント数は259例、必要症例数は405例と設定された。
図1 MODUL: overall study design(発表者の許可を得て掲載)
維持療法におけるAtezolizumab併用レジメンの優越性を検証
2015年8月から2016年11月の間に445例が登録され、297例が試験治療群、148例が標準治療群に割り付けられた。患者背景は、分子生物学的背景因子は試験治療群/標準治療群でそれぞれ、KRAS変異55.3%/56,1%、NRAS変異5.2%/9.2%、microsatellite instability(MSI)2.0%/1.6%、右側結腸21.3%/19.1%であった(図2)。
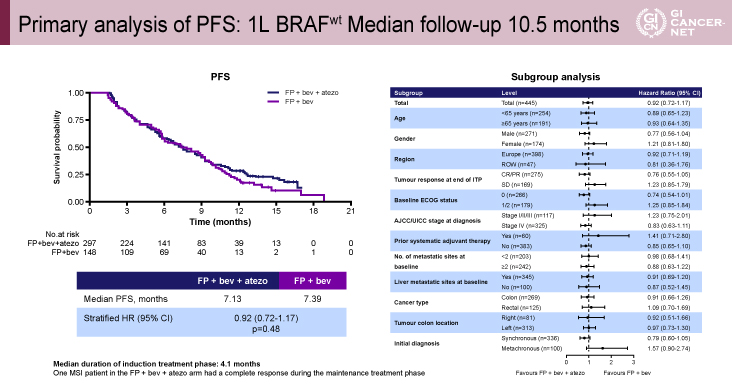
追跡期間中央値10.5ヵ月の時点で主要評価項目であるPFS中央値は、試験治療群7.13ヵ月、標準治療群7.39ヵ月[HR=0.92(95% CI: 0.72-1.17)、p=0.48]であり、統計学的な有意差は認められなかった。サブグループ解析は、男性、初回治療効果がCRとPR、PS 0、同時性転移を有する症例で試験治療群のPFSが良好な傾向にあった(図3)。
追跡期間中央値18.7ヵ月時点におけるupdate analysisの結果も報告されたが、PFS中央値は試験治療群7.20ヵ月、標準治療群7.39ヵ月[HR=0.96(95% CI: 0.77-1.20)、p=0.727]、OS中央値は試験治療群22.05ヵ月、標準治療群21.91ヵ月[HR=0.86(95% CI: 0.66-1.13)、p=0.283]と、いずれにおいても統計学的な有意差は認められなかった。
治療関連有害事象(treatment-emergent adverse event: TEAE)は試験治療群/標準治療群でそれぞれ94.2%/86.7%に認め、grade 3以上は37.5%/30.1%、grade 5は1.0%/0.7%、TEAEによる治療中止は12.3%/11.2%であった。全gradeにおいて10%超のTEAEは試験治療群/標準治療群でそれぞれ、下痢22.5%/13.3%、悪心19.5%/16.8%、疲労15.7%/15.4%、手掌足底発赤知覚不全症候群14.3%/17.5%、高血圧15.0%/9.8%、関節痛13.3%/2.8%、発熱10.9%/9.1%、無力症10.6%/7.7%、末梢神経障害10.2%/10.5%であった。また、全gradeにおける免疫関連TEAEは標準治療群ではみられなかったが、試験治療群では、甲状腺機能低下症7.5%、甲状腺機能亢進症5.1%、甲状腺炎0.3%、自己免疫性肝炎0.7%、腸炎1.4%、自己免疫性腸炎0.3%、肺炎0.3%、角膜炎0.3%、ぶどう膜炎0.3%であった。
図2 Summary of baseline and demographic characteristics at randomisation: 1L BRAFwt(発表者の許可を得て掲載)
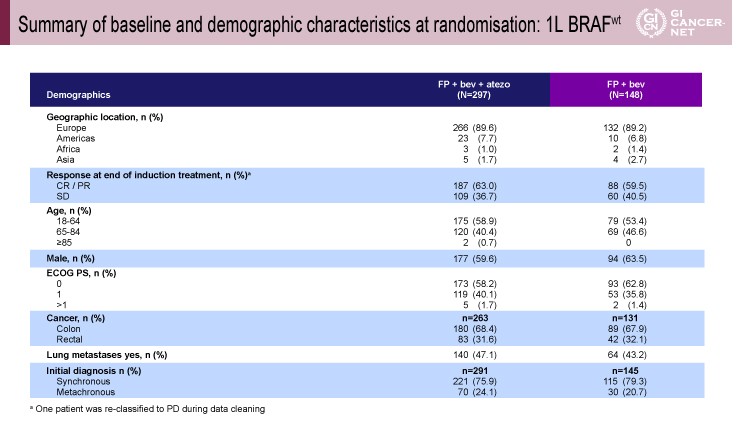
図3 Primary analysis of PFS: 1L BRAFwt Median follow-up 10.5 months(発表者の許可を得て掲載)
まとめ
BRAF野生型の切除不能進行・再発大腸癌初回治療例に対する導入化学療法後の維持療法において、フッ化ピリミジン系薬剤+Bmab併用療法に対するフッ化ピリミジン系薬剤+Bmab+Atezolizumab併用療法の有効性は示されなかった。
(レポート:静岡県立静岡がんセンター 消化器内科 レジデント 白数 洋充)
References
- 1) COTEZO試験:Bendell J, et al.: WCGC 2018 #LBA-004[Annals of Oncology]
- 2) Terme M, et al.: Cancer Res. 73(2): 539-549, 2013[PubMed]
- 3) Le DT, et al.: N Engl J Med. 372(26): 2509-2520, 2015[PubMed]
- 4) Chen DS, et al.: Immunity. 39(1): 1-10, 2013[PubMed]
関連サイト
- ・MODUL試験[ClinicalTrials.gov]

山﨑 健太郎 先生
静岡県立静岡がんセンター 消化器内科 医長