全身化学療法に不応または不耐の進行肝細胞癌に対するPD-1抗体であるCamrelizumab(SHR-1210)の無作為化第II相試験
A randomized multicentered phase 2 study to evaluate SHR-1210 (PD-1 antibody) in subjects with advanced hepatocellular carcinoma (HCC) who failed or intolerable to prior systemic treatment.
Shu K. Qin, et al.
監修コメント
進行肝細胞癌の標準治療は血管新生阻害薬であり、次の世代の治療として免疫チェックポイント阻害薬が注目されている。本試験も、そのような状況で実施され、新たな免疫チェックポイント阻害薬が中国で開発されているようである。
本試験の目的はやや理解しにくく、220例での無作為化セレクションデザイン第II相試験にどの程度意義があるのかは不明である。一方で、約1年間で登録が終了しており、中国に肝細胞癌患者がいかに多いかを反映しているように感じる。本治療を、初回治療として開発していくのか、それとも二次治療として開発していくのか、いずれにしても、今後の血管新生阻害薬との第III相試験が必要と思われる。本試験は、Camrelizumab(SHR-1210)の投与方法の比較であり、この結果によって、第III相試験に移行するかしないのかを果たして判断できるのであろうか。今後、われわれが肝細胞癌のグルーバル開発を行っていく上で、中国をパートナーとして考えていくのかどうかは重要な点である。そのような観点からは、非常に結果が注目される試験といえる。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
進行肝細胞癌に対する免疫チェックポイント阻害薬併用投与の有効性が示唆されている
進行肝細胞癌患者に対する1st-lineの標準治療は、中国ではSorafenibとOxaliplatin(OX)を含む殺細胞性抗癌薬である。二次治療としてはRegorafenib(REG)が承認されているが、新たな薬剤開発が行われている。免疫チェックポイント阻害薬であるPD-1抗体は、Sorafenib治療後の進行肝細胞癌患者に対して有望な薬剤とされている1,2)。Camrelizumab(SHR-1210)はPD-1に対する新しいヒト化IgG4モノクローナル抗体であり、第I相試験において、安全性に加えて良好な有効性が示唆されている3)。そこで、進行肝細胞癌患者に対して、Camrelizumab(SHR-1210)の有効性を検討することを目的とした、非盲検無作為化第II相臨床試験が実施された。
Camrelizumab(SHR-1210)投与の主要評価項目は、全奏効割合(ORR)と6ヵ月生存(OS)割合
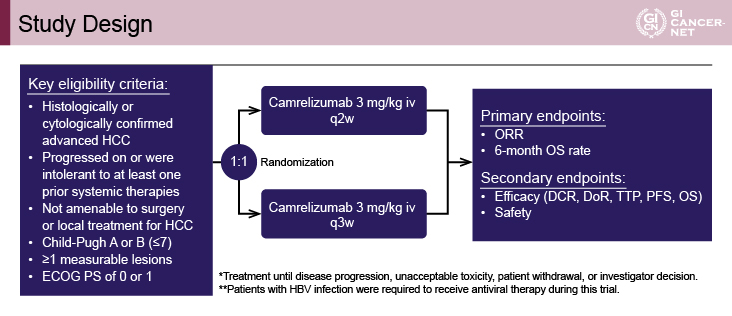
対象は、組織学的に確認された進行肝細胞癌患者とされた。その他の主な適格基準として、少なくとも1つの全身化学療法に不応または不耐、ECOG PS(performance status)0または1、Child-Pughスコア7点まで、1つ以上の測定可能病変を有する、などが設定された。患者は2週間または3週間を1サイクルとする2群に1:1で無作為化され、Camrelizumab(SHR-1210)3mg/kgをそれぞれ2週または3週間隔で投与された(図1)。
主要評価項目には、完全独立中央審査(blinded independent central review)によってRECIST ver1.1に基づき評価された全奏効割合(ORR)と6ヵ月生存(OS)割合が設定された。また、抗腫瘍効果も評価された。副次評価項目として、有効性[腫瘍制御割合(病勢コントロール割合:DCR)、奏効期間(DR)、無増悪期間(TTP)、無増悪生存(PFS)期間、全生存(OS)期間]および安全性が設定された。
2016年11月15日から2017年11月16日までの12ヵ月で220例が登録され、2週間隔投与群(q2w群)に111例、3週間隔投与群(q3w群)に109例が割り付けられた。治療が行われなかったq2w群2例とq3w群1例を除く、q2w群109例およびq3w群108例が安全性および有効性の解析対象とされた。2018年5月16日のデータカットオフ時点でq2w群83例、q3w群80例が治療を中止し、観察期間中央値は8.6ヵ月であった。
患者背景は両群に差はなく、両群合計217例の年齢中央値は49歳、男性が90.3%を占め、Child-Pughスコアは5点または6点が98.2%、肝細胞癌の成因は、B型肝炎ウイルス(HBV)が83.9%であった。81.6%が肝外病変を有し、α-フェトプロテイン(AFP)値が400ng/mL以上は51.2%であった。前治療として、89.4%が分子標的治療薬、29.5%が化学療法を受けていた。
図1 Study design(発表者の許可を得て掲載)
Camrelizumab(SHR-1210)の毒性は管理可能で、良好な有効性が示唆された
主要評価項目であるORRは全体で13.8%[95%信頼区間(CI): 9.5-19.1]、q2w群11.0%(95% CI: 5.8-18.4)、q3w群16.7%(95% CI: 10.2-25.1)であり、6ヵ月OS割合は全体で74.7%(95% CI: 68.3-79.9)、q2w群76.1%(95% CI: 67.0-83.1)、q3w群73.1%(95% CI: 63.7-80.5)であった(図2)。副次評価項目である腫瘍制御割合44.7%、DR中央値は未達、TTP中央値2.6ヵ月、PFS期間中央値2.1ヵ月、OS期間中央値14.4ヵ月であった。
安全性について、治療に関連したgrade 3または4の有害事象を19.4%に、治療関連死を0.9%に、重篤な有害事象を9.7%に認めた。10%以上の患者に認められた有害事象はRCEP(reactive cutaneous capillary endothelial proliferation)66.8%、AST増加(24.4%)、ALT増加(23.0%)、蛋白尿(23.0%)、血中ビリルビン増加(16.6%)、血小板数減少(15.2%)、白血球数減少(10.6%)であったが、5%以上の患者に発現するgrade 3以上の有害事象は認められなかった。
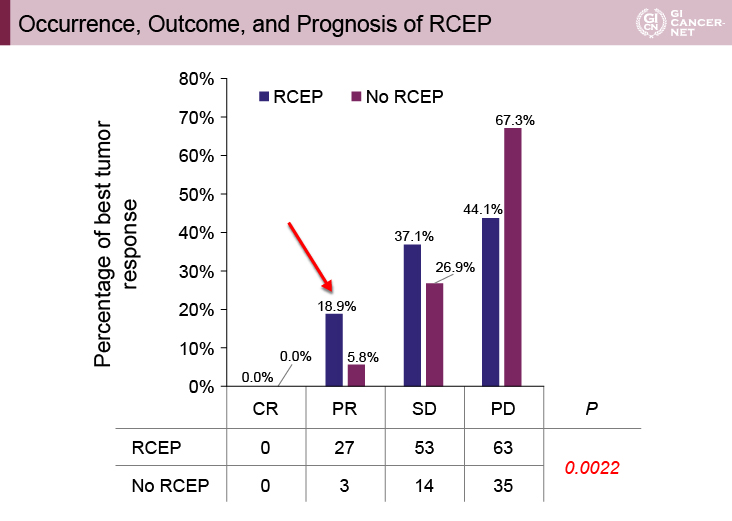
RCEPは全体で145例に認められ、全例がgrade 1または2、145例中106例(73.1%)は初回治療期間に発現し、80例(55%)で回復または改善した。RCEPを発現した患者の奏効割合が18.9%であったのに対して、RCEPを発現しなかった患者の奏効割合は5.8%であり、RCEPの発現は抗腫瘍効果と強く関連していた(図3)。
図2 Confirmed ORR and 6-month OS rate(発表者の許可を得て掲載)
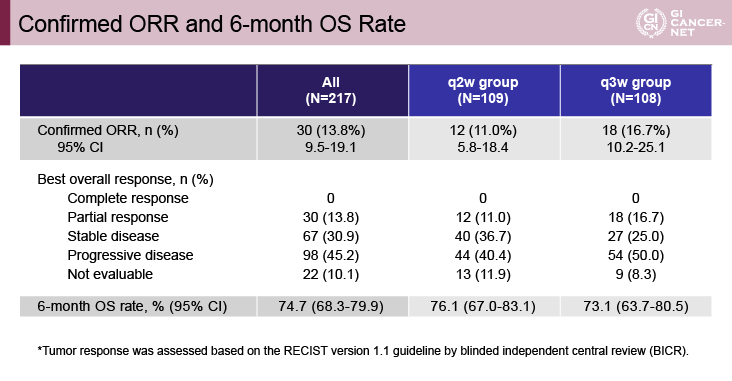
図3 Occurrence, Outcome, and Prognosis of RCEP(発表者の許可を得て掲載)
まとめ
進行肝細胞癌に対するCamrelizumabの有害事象は管理可能であり、臨床的意義のある抗腫瘍効果を示した。
(レポート:金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
References
関連サイト
- ・KEYNOTE-224試験[ClinicalTrials.gov]

上野 誠 先生
神奈川県立がんセンター 消化器内科 医長