切除可能胃癌/食道胃接合部腺癌に対する周術期FLOT療法+Avelumab=FLOT-A療法の安全性とバイオマーカーデータ(ICONIC試験:第II相試験の安全性パート)
Perioperative FLOT + anti-PD-L1 Avelumab (FLOT-A) chemo-immunotherapy in resectable oesophagogastric adenocarcinoma: safety and biomarker data from the ICONIC trial safety run-in
Michael Davidson, et al.
監修コメント
胃癌および食道胃接合部腺癌に対するFLOT療法[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX))+Docetaxel(DTX)]は、FLOT4試験の結果から、欧州では周術期化学療法の標準治療のひとつである。今回、Avelumabとの併用についてfull doseでの忍容性が示された。切除不能胃癌において有効性が示された抗PD-1/L1抗体療法は、周術期での化学(放射線)療法への上乗せを検証する臨床試験が複数進行中である。今回のESMO 2019では、胃癌の術前化学療法の検証試験がアジアから報告され、本邦でも術前化学療法が実地臨床でも広がっていくことが予想される。術前での使用は、手術時の腫瘍組織検体が豊富に採取可能であり、バイオマーカー解析も比較的容易である。未だ明らかになっていない、胃癌における免疫療法の効果予測バイオマーカーが解明されていくことを期待したい。
(コメント・監修:国立がん研究センター東病院 消化管内科 医長 谷口 浩也)
周術期FLOT療法への免疫療法の併用は有用か?
周術期FLOT療法[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)+Docetaxel(DTX)]は、切除可能な食道胃接合部腺癌および胃癌に対する標準治療のひとつである1)が、3年生存割合は57%であり、新たな併用療法による生存の改善が望まれる。免疫原性細胞死(immunogenic cell death:ICD)を誘導する化学療法(FLOT療法)とPD-L1阻害薬の併用は、相乗効果が期待される。
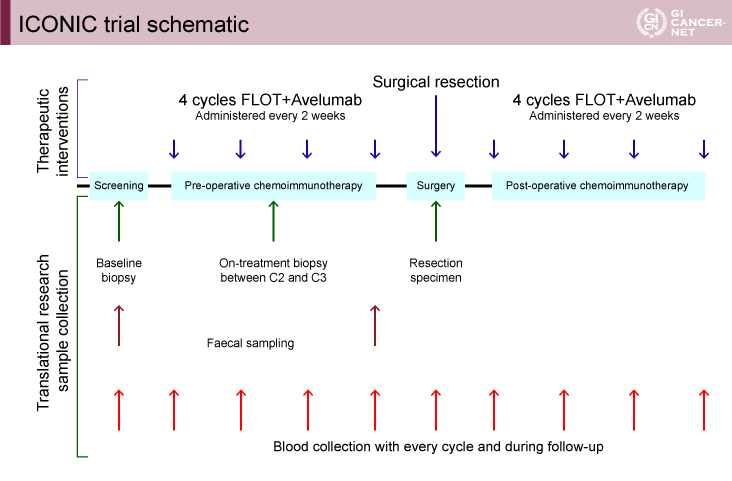
ICONIC試験は、切除可能な食道胃接合部腺癌および胃癌に対する術前、術後それぞれ4コースのFLOT+Avelumab併用=FLOT-A療法の有効性と安全性を評価するための単群第II相試験である(図1)。今回は安全性パートにおける安全性と治療早期のトランスレーショナルデータが報告された。
図1 ICONIC trial schematic(発表者の許可を得て掲載)
3+3デザインを用いた安全性パートで推奨用量を設定
用量探索のため3+3デザインを用いた安全性パートが実施された。開始用量は標準用量のFLOT療法に加えAvelumab 10mg/kgを2週ごと(dose level 0)の投与とし、dose level -1を7mg/kgと設定した。用量制限毒性(DLT)は、初回投与後28日以内を評価した。
その後、40症例に対して、安全性パートで決定したAvelumabの推奨用量とFLOT療法を併用施行し、切除を行う有効性パートが行われた。有効性パートでの主要評価項目は、病理学的完全奏効(pathological complete response:pCR)割合とした。
A’hernデザインを用いてpCR割合の閾値10%、期待値25%として、検出力80%、有意水準片側0.05と設定して40症例が必要と算出した。
周術期FLOT-A療法施行中、術中/術後における忍容性が示された
データカットオフの時点で、6症例で術前化学療法と手術を施行した。最初の3症例中1例で5-FU投与中の胸痛を認め、dose level 0に3症例追加となったが、DLTは認めず、dose level 0(Avelumab 10mg/kg、2週ごと)を推奨用量と決定した。
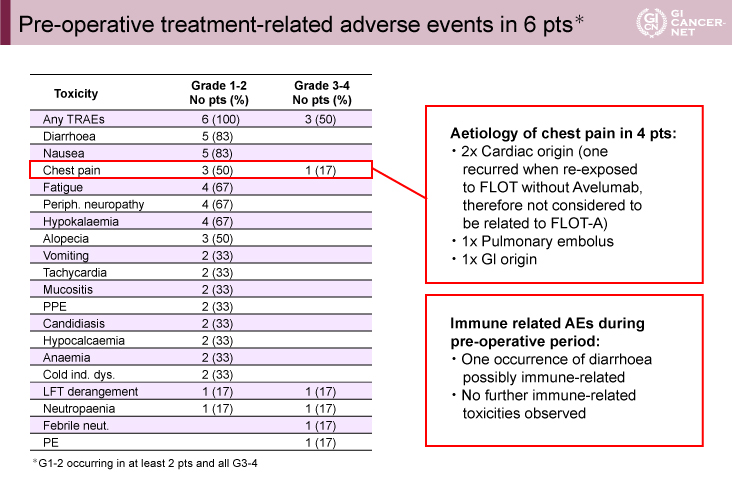
術前FLOT-A療法中、6例中6例でGrade 1/2の有害事象が発現し、Grade 3/4の有害事象は6例中3例で認めた。6例中4例で胸痛を認め、3例がGrade 1/2、1例がGrade 3/4であった。2例は心臓由来の胸痛、肺塞栓と消化管由来の胸痛がそれぞれ1例ずつであった。免疫関連有害事象と考えられる有害事象は下痢の1例であった(表1)。6例中3例が術前FLOT-A療法4コースを完遂した。全6症例が切除に進み、想定外の合併症は認めなかった。
表1 Pre-operative treatment-related adverse events in 6 pts*(発表者の許可を得て掲載)
探索的トランスレーショナルリサーチ
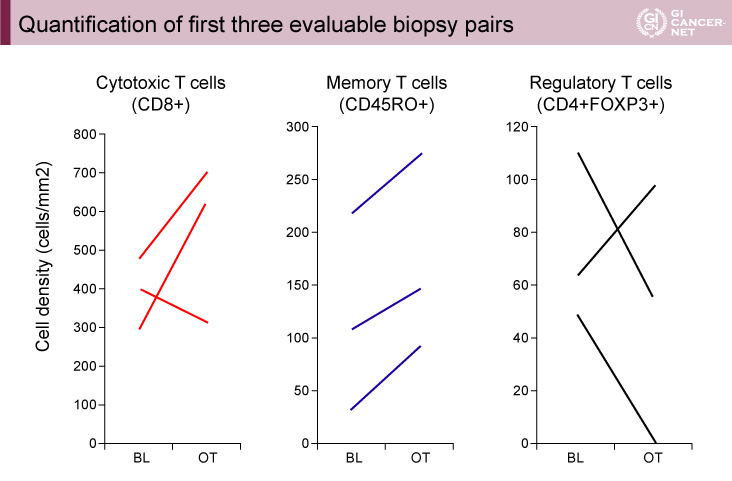
生検では、細胞障害性T細胞(CD8+)の増加(3例中2例)、メモリーT細胞(CD45RO+)の増加(3例中3例)、抑制性T細胞(CD4+FOXP3+)の減少(3例中2例)が認められた(図2)。
効果予測因子として、また化学免疫療法への感受性および耐性の分子学的および細胞学的機序を解明するため、ドライバー遺伝子異常、遺伝子変異量、RNA発現プロファイル、腸内細菌叢、血中循環腫瘍DNA(circulating tumor DNA:ctDNA)の変動が現在、研究されている。
図2 Quantification of first three evaluable biopsy pairs(発表者の許可を得て掲載)
まとめ
周術期において、FLOT療法は免疫チェックポイント阻害薬と安全に併用できることを示す最初の報告である。標準用量のFLOT+Avelumab 10mg/kg(FLOT-A療法)は忍容可能な毒性プロファイルであり、術中、および術後において想定外の合併症は認めなかった。病態は異なるものの6例中4症例で胸痛を認め、現在進行中の有効性パートにおいて、慎重に観察され、評価されていく予定である。
(レポート:大分大学医学部附属病院 腫瘍内科 小森 梓)
Reference
- 1) Al-Batran SE, et al.: Lancet. 393(10184): 1948-1957, 2019 [PubMed]
関連サイト
- ・ICONIC試験 [ClinicalTrials.gov]
- ・FLOT4試験 [ClinicalTrials.gov][学会レポート(ASCO 2017 #4004)]

谷口 浩也 先生
国立がん研究センター東病院 消化管内科 医長