既治療の切除不能進行・再発胃癌に対するS-1とTAS-114併用療法の多施設共同第II相試験:EPOC1604試験
A multicenter phase II study of TAS-114 in combination with S-1 in patients with pre-treated advanced gastric cancer (EPOC1604)
Daisuke Takahari, et al.
監修コメント
Fluorouracil(5-FU)による抗腫瘍効果は、代謝産物によるDNA合成阻害とRNA合成阻害であると言われている。5-FUの代謝物であるFdUMPがチミジル酸合成酵素(thymidylate synthase:TS)、活性化型葉酸とternary complex(三重複合体)を形成し、TSの活性を阻害したり、あるいは別の代謝物であるFdUTPがDNAに取り込まれることでDNA合成阻害を起こしたり、またFUTP(5-fluorouridine-5'-triphosphate)がRNAに取り込まれることでRNA合成阻害を発揮し、抗腫瘍効果を発揮する。TAS-114は経口のdUTPase(deoxyuridine 5'-triphosphate nucleotidohydrolase)阻害剤であり、5-FUの抗腫瘍効果物の1つである、FdUTPを分解するdUTPaseを阻害する作用をもつ。5-FU系薬剤とTAS-114との併用による相乗効果が基礎的実験により報告されており1)、また、dUTPaseの活性上昇が耐性機序の1つに挙げられており、5-FUに耐性となった腫瘍でも、TAS-114との併用で耐性が克服できるのでは? という仮説が立てられていた。胃癌および肺癌において、臨床試験が計画され、S-1との併用療法における評価が行われた。
今回の報告は胃癌での報告であり、全例が5-FU系薬剤による前治療を受けた症例であり、5-FUに耐性となっている症例である。耐性克服に期待がかかったが、結果は主要評価項目であるobjective response rate(objective RR)で5.0%と、期待された有効性は示されなかった。病勢コントロール割合(DCR)や、全生存(OS)割合が比較的高いのは、より良い状態の患者が登録されていることが推測され、薬効としては厳しい結果となった。同時期に行われていた肺癌の試験でも、有効性が期待できないとの結論となり、20例登録された時点で症例集積が終了されている。dUTPase H scoreが高い群では、より高い腫瘍効果が示されており、薬剤耐性機序によっては有効性が期待できる可能性も示唆されているが、多数の耐性機序があることを考えると、これ以上の治療開発は厳しいと考えられた。
ただ、このような薬剤の組み合わせによるBiochemical Modulation(生化学的修飾:BCM)は日本の得意分野であり、単独では薬効が少ない薬剤を代謝物の阻害剤を併用させて薬効を選択的に高める試みは、今後も検討されるべきである。また、可能性のある組み合わせを短期間で検討し、早いうちにGo/No Goの判断を下せるような体制整備は、国際競争力を付ける上でも重要である。今回のEPOC1604試験は結果としてはネガティブであったが、医師主導治験として、1年以内に患者集積を行い、結果を出していったということについては評価ができる試験である。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
切除不能進行・再発胃癌ではFluorouracil(5-FU)抵抗性の機序が関連
5-FU代謝経路に関与する主要な酵素であるdUTPase(deoxyuridine 5'-triphosphate nucleotidohydrolase)は、腫瘍組織に高発現している場合、5-FU抵抗性に関連すると報告されている2,3)。
TAS-114は経口のdUTPase阻害剤で、5-FU等のフッ化ピリミジン系薬剤の抗腫瘍効果を増強し4)、非小細胞肺癌と胃癌を対象としたS-1とTAS-114を併用した第I相試験においては、忍容性は保たれ潜在的な有効性も示唆された5)。
そのため、切除不能進行・再発胃癌におけるS-1とTAS-114併用療法の有効性と安全性を検討するために、EPOC1604試験が実施された。
objective response rate(objective RR)を主要評価項目とし、フッ化ピリミジン系薬剤既治療例におけるS-1とTAS-114併用療法の有効性と安全性を検討
本試験のデザインは、S-1とTAS-114併用療法の有効性と安全性を検討する単群の多施設共同第II相試験である。
本試験の主な適格基準は、組織学的に診断された切除不能進行・再発胃癌で、ECOG PS(Eastern Cooperative Oncology Group performance status)0/1、フッ化ピリミジン系薬剤とプラチナ系薬剤の投与歴を有し、タキサン系薬剤またはIrinotecan(IRI)の投与歴(2レジメン以上の前治療歴)を有すること、測定可能病変を有すること、臓器機能が保たれていることであった。
治療スケジュールは、S-1 30mg/m2/回と、TAS-114 400mg/回(食間に1日2回)を、14日間連続で内服後7日間休薬する計21日間を1コースとして、同薬剤に不応または不耐となるまで継続した。
主要評価項目はobjective RRであり、Simonの二段階デザインに基づき、objective RR 25%、閾値objective RR 5%、有意水準5%、検出力80%と仮定し、症例数は29例と設定された。
副次評価項目は、病勢コントロール割合(DCR)、無増悪生存(PFS)期間、全生存(OS)割合、有害事象であった。
S-1とTAS-114併用療法の忍容性は保たれていたが、有効性は限定的
本試験には2017年10月から2018年6月の期間に20例が登録された。ただし他試験で有効性が認められず、2018年6月に登録を終了した。
登録症例の背景は、年齢中央値(範囲)65歳(34-77歳)、ECOG PS 0が15例(75%)、1が5例(25%)、手術歴なし11例(55%)、転移臓器は肝が8例(40%)、腹膜が5例(25%)、前治療レジメン数は1/2回が5例(25%)、≧3回が15例(75%)、組織型はdiffuseが9例(45%)、intestinalが11例(55%)、HER2陽性が5例(25%)であり、全例でフッ化ピリミジン系薬剤およびプラチナ系薬剤、タキサン系薬剤の投与歴があった(表1)。
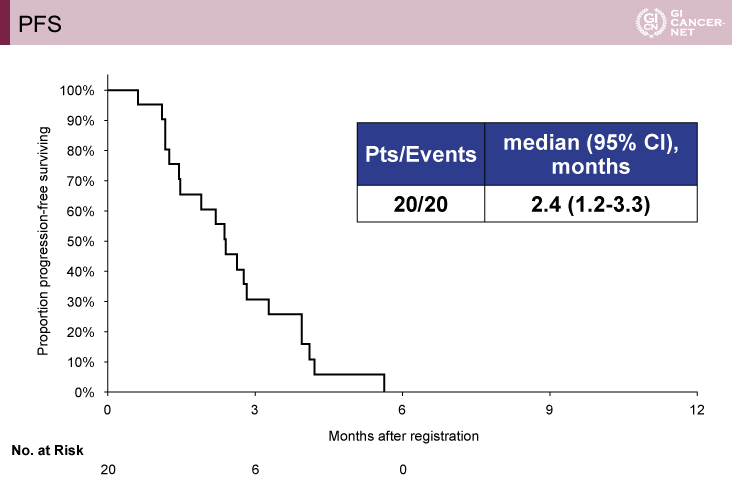
主要評価項目であるobjective RRは5.0%(95% CI: 0.1-24.9)で、有効性の副次評価項目であるDCRは70.0%(95% CI: 45.7-88.1)であった(図1)。生存時間解析に関しては、PFS期間中央値が2.4ヵ月(95% CI: 1.2-3.3)(図2)、OS期間中央値が7.1ヵ月(95% CI: 5.2-9.4)であった。なお、細胞質におけるdUTPase H scoreで高値/低値の2群に分けた生存時間解析では、PFS期間中央値が高値群では2.8ヵ月(95% CI: 1.4-3.9)、低値群では1.6ヵ月(95% CI: 0.6-2.4)で、有意差を認めた(log-rank検定、p=0.0473)。
表1 Baseline Characteristics(発表者の許可を得て掲載)
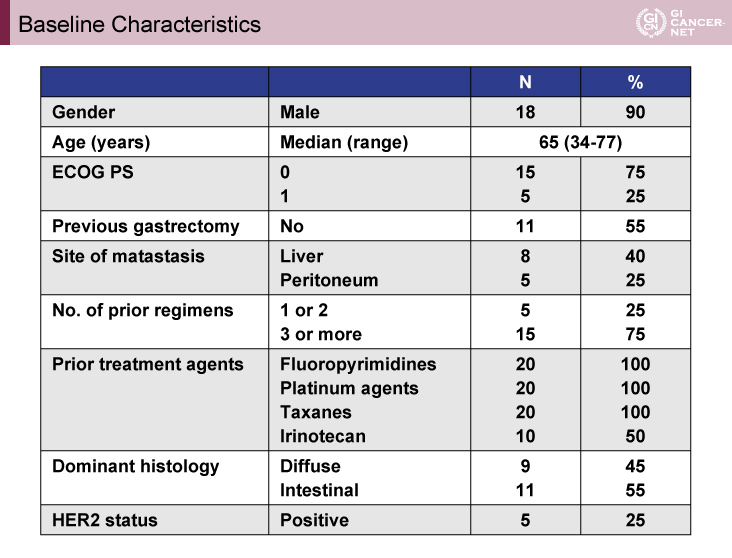
図1 Waterfall plot of best tumor shrinkage(発表者の許可を得て掲載)
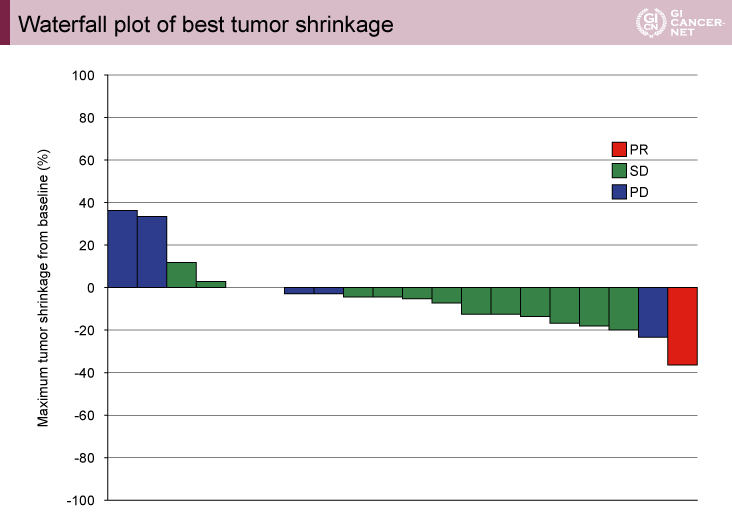
図2 PFS(発表者の許可を得て掲載)
主な安全性
安全性に関しては、治療関連有害事象が18例(90%)で認められ、そのうちGrade 3以上の有害事象を9例(45%)で認めた。Grade 3以上の具体的な治療関連有害事象として、貧血4例(20%)、白血球減少3例(15%)、好中球減少2例(10%)、血小板減少1例(5%)、皮疹2例(10%)を認めた。
まとめ
既治療の切除不能進行・再発胃癌に対するS-1とTAS-114併用療法の忍容性は保たれていたが、有効性は限定的であった。
(レポート:国立がん研究センター中央病院 消化管内科 山本 駿)
References
- 1) Yano W, et al.: Mol Cancer Ther. 17(8): 1683-1693, 2018 [PubMed][Mol Cancer Ther]
- 2) Ladner RD, et al.: Cancer Res. 60(13): 3493-3503, 2000 [PubMed]
- 3) Adlard JW, et al.: J Clin Oncol. 22: Abstract #9506, 2004
- 4) Richman S, et al.: J Clin Oncol. 24: 2006
- 5) Doi T, et al.: Invest New Drugs. 37(3): 507-518, 2019 [PubMed]
関連サイト
- ・EPOC1604試験 [UMIN]

加藤 健 先生
国立がん研究センター中央病院 消化管内科 医長