2017年1月19日~21日に米国サンフランシスコにて開催された2017年 消化器癌シンポジウム(2017 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
胃癌
進行胃癌に対するRamucirumab+Pembrolizumab第Ⅰ相試験の安全性および有効性の中間解析(KEYNOTE-098試験)
Interim safety and clinical activity in patients …
Ian Chau, et al.
Expert’s view

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
免疫チェックポイント阻害剤の効果は、単剤では20%程度であり、効果を認める症例は長期持続するが、効果を認めない症例に関してはまったく効果がみられないことが分かってきた。また、PD-L1陰性症例に対しては、効果を認めないわけではないが、高価な薬価に見合うだけの効果が期待できるかが問題となっている。
こういった課題に対して、種々の併用療法が試みられている。化学療法との併用、免疫チェックポイント阻害剤同士の併用、そして分子標的薬との併用などが行われているが、血管新生阻害剤と免疫チェックポイント阻害剤の併用のproof of conceptとなるのが本試験である。VEGFRをブロックすることで細胞傷害性Tリンパ球の組織への集積が上昇し、抗PD-1抗体薬の効果を増強するだろう、というのがこの併用療法のrationaleである。マルチコホートのうち非小細胞肺癌についての結果は既に報告されており、併用により安全かつ有効、しかもPD-L1発現にかかわらず効果が期待できることが報告されている。今回は2nd-line以降の胃癌患者を対象にしたコホートの成績が報告された。
本試験における、短期的有効性の指標である、奏効割合、病勢コントロール割合、PFS中央値、6ヵ月PFS割合は、それぞれ10%、46%、2.1~2.6ヵ月、20~40%程度であった。一方で、Pembrolizumab単剤(PD-L1陽性胃癌)では、それぞれ22%、36%、1.9ヵ月、26%1)、Nivolumab単剤(全胃癌患者)では、それぞれ11.2%、40.3%、1.61ヵ月、20%程度2)、Ramucirumab単剤では、3%、49%、2.1ヵ月、20%弱3)である。本試験の結果としては、腫瘍縮小効果は単剤と差はないものの、6ヵ月PFS割合の結果より、効果が持続する可能性が示唆されている。また、併用により有害事象が増加する可能性は少ないと思われた。
観察期間1年以内と短く少数例のため、有効性や安全性について断定的なことは言えず、さらなる追跡が望まれる。一方で、PD-L1陰性例でも腫瘍縮小が得られており、単剤では効果が少ない対象にも効果を認めることが示唆された。今年報告が期待されるRAINFALL試験(胃癌1st-lineにおけるXP療法±Ramucirumab)4)の結果、初回化学療法例に対してRamucirumab併用が標準となった場合、さらにPembrolizumabを併用する試験を考慮するうえでも重要なデータとなる。
本邦では、医師主導治験として、Ramucirumab+Nivolumab併用の第I/II相試験5)が開始されており、結果が待たれるところである。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
VEGFR2とPD-1を標的とした初の治療
血管新生と免疫抑制は腫瘍細胞の特徴的な増殖機序であり、非臨床試験においてprogrammed cell death 1 (PD-1)とvascular endothelial growth factor receptor 2 (VEGFR2)の同時阻害は、相加的な毒性を伴わない相乗的な抗腫瘍効果が確認されている6)。本試験は、全身化学療法に不応の胃癌、非小細胞肺癌、尿路上皮癌、胆道癌を対象とした、現在進行中のRamucirumabおよびPembrolizumab併用療法の第Ia/b相試験である。主要評価項目は安全性と忍容性の評価であり、本報告では、胃癌コホートにおける予備的な抗腫瘍効果が合わせて報告された。
進行胃癌に対するRamucirumabとPembrolizumab併用療法の有効性を検証した初の第I相試験
対象は、ECOG PS 0-1、標的病変あり(RECIST v1.1)かつ主要臓器機能が保たれている、組織学的に腺癌と確認された胃・食道胃接合部癌(Siewert Type I, II, III)で、プラチナ製剤、フッ化ピリミジン系製剤を含む1-2 lineに不応となった症例である。なお、VEGF/VEGFR、PD-1/PD-L1、PD-L1/PD-L2を標的とした治療歴がある症例、扁平上皮細胞癌/未分化型腺癌、登録前6ヵ月以内の血栓塞栓症、消化管穿孔/瘻孔がある症例、脳転移、免疫不全、コントロール不良の感染症を有する症例は除外された。
治療スケジュールは、Pembrolizumabを200mg, 3週毎投与で固定し、Ramucirumabを8mg/kg, day1,8投与(スケジュール1)、10mg/kg, day1投与(スケジュール2)を行う2種類である。第Ia相試験としてDLT(dose-limiting toxicity)評価を行った後、第Ib相試験として各癌腫におけるコホート拡大試験が行われ、2nd-line以降の胃癌患者は、スケジュール1のコホートA、スケジュール2のコホートBが設定された。治療効果判定は、治療開始後の最初の24週間は6週毎に、その後は12週毎に、RECISTおよびirRECISTに従って評価した。データカットオフは2016年10月21日である。
Ramucirumab+Pembrolizumabは忍容可能なレジメン
コホートA(24例)/コホートB(17例)の患者背景は、年齢中央値(範囲)が56(24-78)歳/61(28-73)歳、治療ラインは3rd-lineが12例/8例、4th-line以降が3例/0例、PD-L1陽性が9例/10例であった。また、治療継続期間中央値はコホートA 2.8ヵ月、コホートB 4.1ヵ月であった。
Grade 3以上の注意すべき治療関連有害事象は、コホートAでは高血圧2例(8%)、腸炎1例(4%)、肺塞栓症1例(4%)であり、コホートBでは腸炎2例(12%)、急速輸注反応1例(6%)、高血圧1例(6%)、内分泌障害1例(6%)、下痢1例(6%)であった(表)。なお、第Ia相試験の3rd-lineの食道胃接合部癌1例に5つのDLT(腹痛、肝炎、胆汁うっ滞、間質性肺炎、腸炎)を認めた。
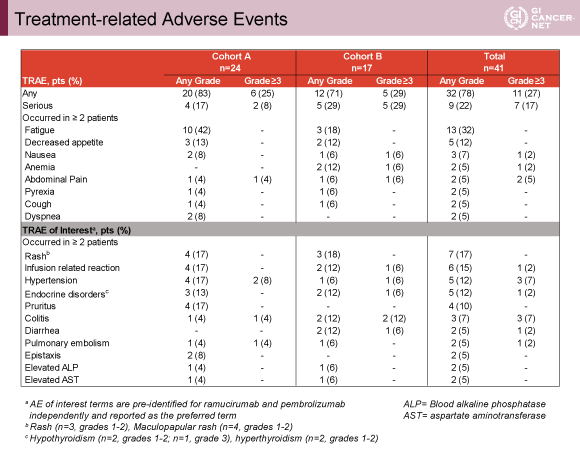
発表者の許可を得て掲載(approved by Ian Chau)
有効性に関しては、奏効割合はコホートA 13%、コホートB 6%、病勢コントロール割合はそれぞれ42%、53%であった。評価可能な症例の56%で標的病変の縮小を認め(図)、部分奏効4例(PD-L1陽性2例、陰性1例、不明1例)だった。カットオフ時点で治療継続中の症例は、コホートA 6例、コホートB 7例で、治療中止理由はコホートA/Bでそれぞれ、腫瘍増悪(14例/6例)、死亡(4例/1例)、追跡中止(0例/1例)、主治医判断(0例/1例)、同意撤回(0例/1例)であった。また、PFS中央値は、コホートA 2.10ヵ月(1.3-4.0)、コホートB 2.60ヵ月(1.4-NR)であった。
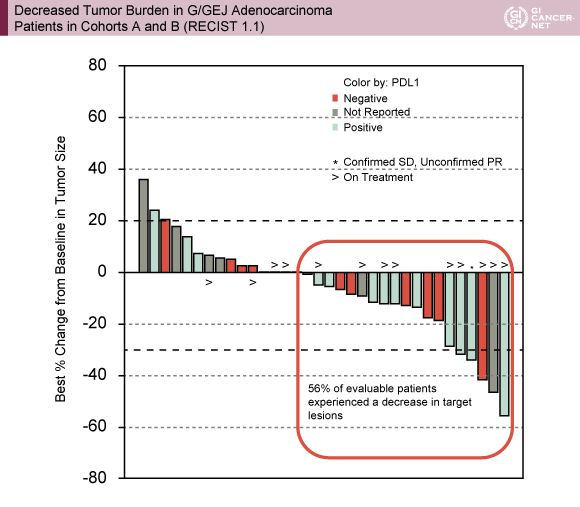
発表者の許可を得て掲載(approved by Ian Chau)
まとめ
Ramucirumab+Pembrolizumab併用療法の治療関連有害事象は、それぞれの単剤療法と概ね一致しており、相加的な毒性は認めなかった。既治療の進行胃癌に対して抗腫瘍効果を示したが、生存期間の評価に関しては観察期間が不十分である。なお、1st-lineにおける有効性を評価するためにプロトコールが改訂されており、1st-lineのデータを含む追加データが、進行胃癌に対する今後の本療法の開発につながると考えられる。
(レポート:静岡県立静岡がんセンター 消化器内科 レジデント 川上 武志)
Reference
- 1) Muro K, et al.: Lancet Oncol. 17(6): 717-726, 2016[PubMed][論文紹介]
- 2) Kang YK, et al.: 2017 Annual Meeting of American Society of Clinical Oncology®: abstr #2
- 3) Fuchs CS, et al.: Lancet. 383(9911): 31-39, 2014[PubMed][論文紹介]
- 4) A Study of Ramucirumab (LY3009806) in Combination With Capecitabine and Cisplatin in Participants With Stomach Cancer (RAINFALL)[ClinicalTrials.gov]
- 5) フッ化ピリミジンとプラチナ系薬剤に不応不耐進行胃癌患者に対するラムシルマブとニボルマブ併用療法の第I/II 相多施設共同医師主導治験[UMIN-CTR]
- 6) Yasuda S, et al.: Clin Exp Immunol. 172(3): 500-506, 2013[PubMed]

監修・レポーター
監修
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
レポーター
川上 武志先生
静岡県立静岡がんセンター 消化器内科 レジデント
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
成田 有季哉先生
愛知県がんセンター中央病院 薬物療法部 専門員
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
山口 敏史先生
国立がん研究センター中央病院 消化管内科 レジデント