2017年1月19日~21日に米国サンフランシスコにて開催された2017年 消化器癌シンポジウム(2017 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
胃癌
Trastuzumab不応後のHER2陽性胃癌に対するTrastuzumab+CPT-11療法の第Ⅱ相試験―HGCSG1201/OGSG1205
Phase II study of trastuzumab with irinotecan …
Yasuyuki Kawamoto, et al.
Expert’s view

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
抗HER2療法に不応となった後も抗HER2を継続する意義は、HER2陽性乳癌では検証されているものの1)、胃癌ではその有効性は明らかではない。2016年の消化器癌シンポジウムでは、HER2陽性胃癌に対する2nd-lineとしてのT-DM1の有効性が示されず2)、残念な結果となった。本試験は、Trastuzumab(Tmab)療法を継続すること(Trastuzumab beyond progression; TBP)の有効性を探索する第II相試験であったが、症例集積不良により試験が中止され、適格例15例の解析でも有望な結果とは言えなかった。
今回の消化器癌シンポジウムでは、TBP群と非TBP群とを比較する多施設共同観察研究が報告され、本邦からの報告(KSCC1105試験)3)では、TBP群 vs. 非TBP群 でOS中央値12.8 vs. 7.9ヵ月(p=0.010)、フランスからの発表(AGEO試験)4)でもPFS(4.4 vs. 2.3ヵ月, p=0.002)、OS(12.6 vs. 6.1ヵ月, p=0.001)と、両報告ともTBP群が良好な結果を示したが、あくまで観察研究の結果であり、現時点でTBPが標準治療であるとは言えない。本邦ではPaclitaxel単独療法とPaclitaxel+Tmab併用療法の無作為化第II相試験(WJOG7112G試験)5)が実施されており、その結果が待たれる。その後、現在の標準治療であるPaclitaxel+Ramucirumab療法とTBPとの使い分けが議論になってくるだろう。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
胃癌におけるHER2療法継続の意義は?
HER2陽性切除不能進行・再発胃癌に対する1st-lineは、ToGA試験6)の結果からTmab併用療法が標準治療となっている。乳癌領域では、1st-lineでTmabを使用したHER2陽性患者が不応となった後の次治療として、抗HER2療法を継続することが有力な治療選択肢である。本試験では、Tmab併用化学療法が施行されPDとなったHER2陽性切除不能進行・再発胃癌を対象に、2nd-lineとしてIrinotecan(CPT-11)+Tmab併用療法の有効性および安全性を検討した。
HGCSG1201/OGSG1205試験
本試験は、多施設共同、非盲検、単アームの第II相試験である。主な適格基準は、組織学的に診断されている切除不能進行・再発胃癌で、IHC法にて3+またはFISH陽性、ECOG PS 0-2、1st-lineのTmab併用療法後にPDとなった患者を対象とした。対象患者は、Tmab(初回投与量8mg/kg, 2回目以降は6mg/kg, 3週毎)+CPT-11(150mg/kg, 2週毎)が投与された。
主要評価項目はRECIST1.1に基づく奏効率(RR)、副次評価項目はPFS、OS、6ヵ月生存割合、安全性、HER2状況によるサブグループ解析などであった。片側α=0.10、検出力80%で、Tmab上乗せによるRRの閾値を10%、期待値を20%と設定し、必要症例数は60例とした。
症例集積不良による試験中止
本試験は、症例集積不良により必要症例数が見込めず試験が中止された。2012年4月?2015年3月に16例が登録され、1例が除外され15例で解析が行われた。患者背景は、年齢中央値65歳、ECOG PS 0/1が8例/7例、進行/再発が13例/2例、前治療XP+Tmab/SP+Tmabが12例/3例であった。
主要評価項目のRRは 7%(CR 1例、SD 7例、PD 7例)であった(図1)。副次評価項目は、PFS中央値2.4ヵ月(95% CI: 0.0-5.2)(図2)、OS中央値9.7ヵ月(95% CI: 8.2-11.2)であった。
Grade 3以上の有害事象は、好中球減少40%、食欲不振33%、疲労33%であり、主な中止理由はPD 12例、有害事象による中止が3例だった。
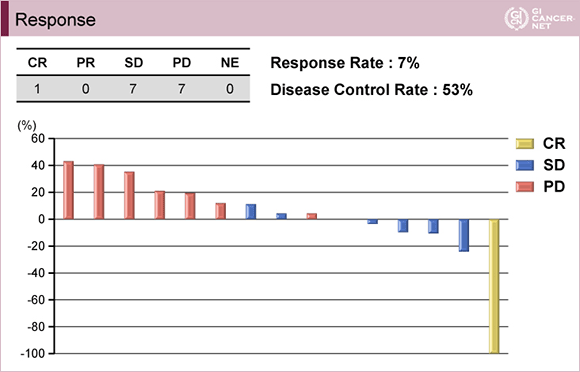
発表者の許可を得て掲載(approved by Yasuyuki Kawamoto)
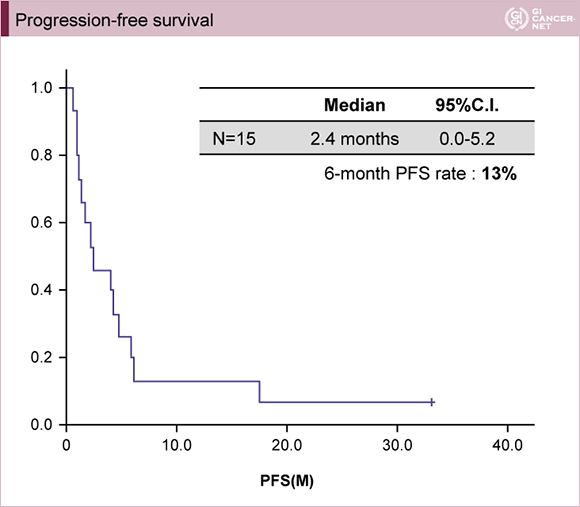
発表者の許可を得て掲載(approved by Yasuyuki Kawamoto)
まとめ
Tmab不応のHER2陽性胃癌に対する2nd-lineとしてのTmab + CPT-11療法の臨床的有用性は認めなかった。
(レポート:国立がん研究センター中央病院 消化管内科 レジデント 山口 敏史)
Reference
- 1) von Minckwitz G, et al.: J Clin Oncol. 27(12): 1999-2006, 2009[PubMed]
- 2) Kang YK, et al.: 2016 Gastrointestinal Cancers Symposium: abstr #05
- 3) Makiyama A, et al.: 2017 Gastrointestinal Cancers Symposium: abstr #93
- 4) Palle J, et al.: 2017 Gastrointestinal Cancers Symposium: abstr #94
- 5) Esaki T, et al.: 2017 Gastrointestinal Cancers Symposium: abstr #TPS218
- 6) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010[PubMed][論文紹介]

監修・レポーター
監修
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
レポーター
川上 武志先生
静岡県立静岡がんセンター 消化器内科 レジデント
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
成田 有季哉先生
愛知県がんセンター中央病院 薬物療法部 専門員
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
山口 敏史先生
国立がん研究センター中央病院 消化管内科 レジデント