2017年1月19日~21日に米国サンフランシスコにて開催された2017年 消化器癌シンポジウム(2017 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
胃癌
3rd-line以降のsalvage lineにおける進行胃癌に対するNivolumab(ONO-4538-12試験)
Nivolumab (ONO-4538/BMS-936558) as salvage treatment …
Yoon-Koo Kang, et al.
Expert’s view

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
免疫チェックポイント阻害剤の大きな波が、ついに消化器癌にもやってきた。そのような感慨を持ってこの試験結果を見守ったのは私だけではないだろう。既に同じ抗PD-1抗体薬であるPembrolizumabのPD-L1陽性胃癌に対する有効性が報告されており1)期待されていたが、承認申請に必要な第III相試験の結果が出たのは、Nivolumabが先となった。
結果としては、PFSでハザード比0.60、OSでハザード比0.63と、十分な差をもって胃癌salvage lineにおける生存期間延長効果を示した。これにより、Nivolumabの適応拡大申請がなされ、2017年秋頃には保険診療として臨床現場で用いることができるようになると想定される。
一方で、奏効割合は約11%と低く、この治療が腫瘍縮小を期待できる治療ではないこと、いったん増大してから縮小を認める、いわゆるpseudo progression(偽増悪)は少ないことなど、Nivolumab単剤療法における限界点なども徐々にわかってきている。悪性黒色腫などでは、10~20%で年単位の予後を示す症例の存在が示されており、胃癌においてもそのような長期にわたり効果を持続する集団が存在するかが注目されるが、今回の解析では観察期間が短いため、まだ長期での効果持続症例の存在は不明である。また、本試験ではPD-L1やKeyとなるバイオマーカーによるサブグループ解析も行われる予定であるため、今後の発表を待つ必要がある。
胃癌における免疫チェックポイント阻害剤の次のステップとしては、より前のラインにおける化学療法との比較、あるいは化学療法や他の免疫チェックポイント阻害剤、分子標的薬との併用など、様々な試みが既に進行中である。今年から来年にかけて、それらの結果が報告される予定であり、胃癌も“免疫時代”に突入したと言える。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
切除不能進行胃癌に対するNivolumab
切除不能進行・再発胃癌に対する1st-lineおよび2nd-lineでは、化学療法による生存期間延長効果が確認されているが2-4)、その予後は12~15ヵ月程度であり、依然不良である。また、3rd-line以降の治療は確立されておらず、有望な治療が望まれている。一方、PD-1を標的とした完全ヒトIgG4モノクロナール抗体であるNivolumabは、様々な固形癌で抗腫瘍効果を示している。Nivolumabを含む免疫チェックポイント阻害剤は、第I/II相試験において胃癌に対する短期的な抗腫瘍効果が認められているが1,5)、無作為化試験における生存期間延長効果については、まだ評価されていない。そこで、切除不能進行・再発胃癌に対する3rd-line以降として、Nivolumabとプラセボを比較する多施設共同二重盲検下無作為化第III相試験が行われた。
2nd-lineに不応の症例を対象
対象は、20歳以上、ECOG PS 0-1で2レジメン以上の化学療法に不応の切除不能進行・再発胃癌患者であり、国(日本 vs. 韓国 vs. 台湾)、ECOG PS(0 vs. 1)、転移臓器個数(<2 vs. ≧2)を層別因子として、Nivolumab(3mg/kg, 2週毎)群とプラセボ群に2:1で割り付けられた。
主要評価項目はOS、副次評価項目はPFS、奏効割合、TTR(time to tumor response)、DOR(duration of response)などであった。OS中央値をプラセボ群4ヵ月に対してNivolumab群6.15ヵ月(HR=0.65)と期待し、片側α=0.025、検出力90%で、261イベントを保証するために必要症例数は290例であった。
Salvage lineでNivolumabはOSを有意に改善
2014年11月~2016年2月の間に493例が登録され、Nivolumab群に330例、プラセボ群に163例が割り付けられた。なお、ITT解析はNivolumab群330例、プラセボ群163例、安全性解析は330例、161例、奏効評価は268例、131例に対して行われた。患者背景は両群間に偏りは認めなかった。
主要評価項目であるOSの中央値は、Nivolumab群5.32ヵ月、プラセボ群4.14ヵ月(HR=0.63, 95% CI: 0.50-0.78, p<0.0001)であり、Nivolumab群で有意な生存期間延長を認めた(図)。また、PFS中央値はNivolumab群1.61 ヵ月、プラセボ群1.45ヵ月(HR=0.60, 95% CI: 0.49-0.75, p<0.0001)、奏効割合はNivolumab群11.2%(95% CI: 7.7-15.6)、プラセボ群0% (95% CI: 0.0-2.8)であった(p<0.0001)。
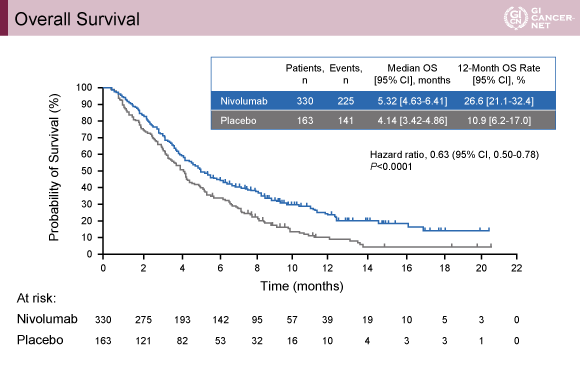
発表者の許可を得て掲載(approved by Yoon-Koo Kang)
Grade 3以上の治療関連有害事象は、Nivolumab群10.3%、プラセボ群4.3%であり、治療中止に至った全gradeの治療関連有害事象は、Nivolumab群2.7%、プラセボ群2.5%であった。なお、Nivolumab群におけるgrade 3以上の治療関連有害事象の内訳は、食欲不振(1.2%)、下痢(0.6%)、疲労(0.6%)、AST上昇(0.6%)、発熱(0.3%)、ALT上昇(0.3%)であり、忍容可能であった。
まとめ
Nivolumabは、前治療のある切除不能進行・再発胃癌に対してプラセボよりもOSを有意に延長し、忍容可能であった。バイオマーカー解析は現在進行中である。本試験により、前治療のある切除不能進行・再発胃癌に対してNivolumabは新たな治療選択肢となり、より前のラインにおけるNivolumabの有効性を探索する強固なrationaleが確立された。
(レポート:静岡県立静岡がんセンター 消化器内科 レジデント 川上 武志)
Reference
- 1) Muro K, et al.: Lancet Oncol. 17(6): 717-726, 2016[PubMed][論文紹介]
- 2) NCCN Clinical Practice Guidelines in Oncology. Gastric Cancer. V3. 2016
- 3) Waddell T, et al.: Ann Oncol. Suppl 6: vi57-63, 2013[PubMed]
- 4) Japanese Gastric Cancer Association: Gastric Cancer. 20(1): 1-19, 2017[PubMed]
- 5) Janjigian YY, et al.: 2016 Annual Meeting of American Society of Clinical Oncology®: abstr #4010

監修・レポーター
監修
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
レポーター
川上 武志先生
静岡県立静岡がんセンター 消化器内科 レジデント
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
成田 有季哉先生
愛知県がんセンター中央病院 薬物療法部 専門員
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
山口 敏史先生
国立がん研究センター中央病院 消化管内科 レジデント