2017年1月19日~21日に米国サンフランシスコにて開催された2017年 消化器癌シンポジウム(2017 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
大腸癌
HER2陽性切除不能進行・再発大腸癌に対するPertuzumab+Trastuzumab併用療法(MyPathway試験の中間解析)
Pertuzumab + trastuzumab for HER2-amplified …
Herbert Hurwitz, et al.
Expert’s view

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
MyPathway試験は、4つの遺伝子異常をもつ固形癌に対して、それぞれの阻害作用をもつ分子標的治療薬を投与し、有効性を評価する非無作為化試験である。今回の報告は、次世代シークエンス(NGS)あるいは、FISH/CISH法、そして免疫組織学的染色(IHC)で3+の大腸癌患者を対象とした、TrastuzumabとPertuzumabの併用成績の結果である。
KRAS野生型かつHER2陽性大腸癌を対象にしたHERACLES試験では、TrastuzumabとLapatinibの併用療法が検討され、奏効割合30%と報告されている1)。そして、MyPathway試験では、KRAS野生型において、奏効割合52%と、HERACLES試験と同様に良好な治療効果を示した。一方でKRAS変異型では全例PDの判定であり、何らかの形で増殖シグナルの補充があり、細胞表面の受容体をブロックしても有効ではないことが示唆されている。また、下痢などの副作用の点では、22%にgrade 3の有害事象を認めたLapatinib併用よりもPertuzumab併用の方が有利と推測されるが、今回の報告では具体的な有害事象の記載はなかった。
比較的希少なフラクションであっても確かな効果が期待できる場合、肺癌などでは既にバイオマーカーごとの治療決定が行われている。大腸癌でも、治療開始前に複数の遺伝子変異や増殖などを測定し、バイオマーカー誘導による治療を先に行う時代が近づいていることを感じさせる演題である。現在、国立がん研究センター東病院を中心に、消化器癌を対象とした大規模なゲノムスクリーニング試験GI-SCREENが行われており、そこで指摘されたHER陽性消化管癌を対象に、Pertuzumab+Trastuzumab併用療法の有効性を検討するTRIUMPH試験が医師主導治験として開始される予定である。NGSによるゲノムスクリーニングにより患者のアウトカムを押し上げられるのか、興味深い。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
HER2, BRAF, Hedgehog, EGFR経路を標的としたmulti-basket study
Precision medicineの開発が進むなか、HER2は切除不能進行・再発大腸癌の治療ターゲットとして有用であることが明らかになったが2)、現在抗HER2療法は大腸癌に対して承認されていない。MyPathway試験は、HER2、BRAF、Hedgehog、EGFR経路に遺伝子変異や分子変化を有する進行癌に対して、現在未承認の分子標的薬をそれぞれ投与し(HER2→Pertuzumab+Trastuzumab、BRAF→Vemurafenib、Hedgehog→Vismodegib、EGFR→Erlotinib)、有効性と安全性を評価する、現在進行中の第IIA相試験である。本報告は、HER2増幅/過剰発現切除不能進行・再発大腸癌に対するPertuzumab+Trastuzumab療法の拡大コホートのupdated dataである。
Pertuzumab+Trastuzumabを投与
対象は、治療不応となったHER2増幅/過剰発現(NGS、FISH/CISH、IHC 3+)の切除不能進行・再発大腸癌患者であり、脳転移例、抗癌剤投与中の症例、妊娠例、PertuzumabまたはTrastuzumabの禁忌例は除外された。対象患者は、標準用量のPertuzumab(初回投与量840mg, 2回目以降は420mg, 3週毎)+Trastuzumab(初回投与量8mg/kg, 2回目以降は6mg/kg, 3週毎)を投与され、不応、不耐となるまで継続した。
主要評価項目は担当医判断による全奏効割合(ORR)である。治療効果判定は担当医により最初の24週間は6週毎、その後は12週毎に評価された。なお、CBR(clinical benefit rate)は、CR、PR、または4ヵ月以上SDとなった症例の割合と定義した。
HER2陽性大腸癌に対するPertuzumab+Trastuzumab併用療法は有効
データカットオフ時点の2016年10月15日までに247症例がMyPathway試験に登録され、そのうちHER2増幅/過剰発現の切除不能進行・再発大腸癌患者でPertuzumab+Trastuzumab投与が開始されたのは34例であった。患者背景は、年齢中央値57(25-77)歳、原発部位は右側結腸8例(23.5%)、左側結腸14例(41.1%)、直腸11例(32.4%)、HER2診断方法はNGS 32例(94.1%)、FISH/CISH 11例(32.4%)、IHC 7例(20.6%)、KRAS状況は野生型25例(73.5%)、変異型9例(26.5%)であった。
主要評価項目のORRは、38.2%(95% CI: 22.2-56.4)、CBR 50.0%(95% CI: 32.4-67.6)であった。PRとなった13例中7例は現在もプロトコール治療を継続しており、10例(29.4%)はPDであった(図1)。観察期間中央値5.6ヵ月(1.2-22.1)において、PFS中央値は4.6ヵ月(95% CI: 1.6-9.8)(図2)、OS中央値は10.3ヵ月(95% CI: 7.2-22.1)であった。
KRAS野生型は変異型と比べて良好なORR/CBR(52.0%/68.0% vs. 0%/0%)、PFS延長(5.7ヵ月 vs. 1.4ヵ月)、OS延長(14.0ヵ月 vs. 5.0ヵ月)を認めた。またORRは、右側結腸(12.5%)は左側結腸(42.9%)や直腸(45.5%)と比べて低く、KRAS変異型は右側結腸で多かった(62.5% vs. 7.1% vs. 27.3%)。なお、有害事象は添付文書と概ね一致した。
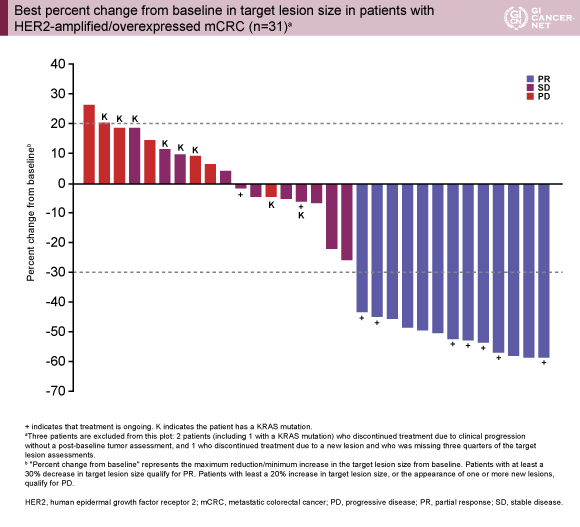
発表者の許可を得て掲載(approved by Herbert Hurwitz)
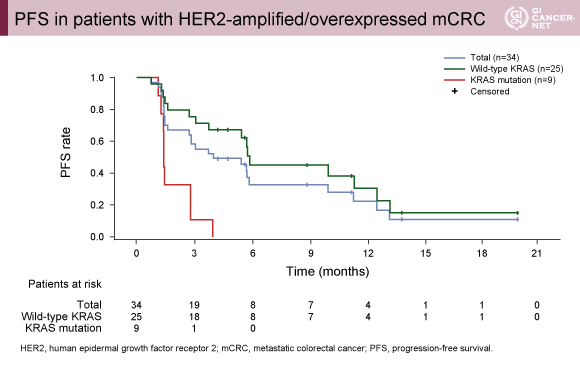
発表者の許可を得て掲載(approved by Herbert Hurwitz)
まとめ
MyPathway試験の中間解析において、抗癌剤を使用しないPertuzumab+TrastuzumabによるHER2標的治療は、治療歴のあるHER2増幅/過剰発現の切除不能進行・再発大腸癌に対して抗腫瘍活性を示した。また、Pertuzumab+TrastuzumabはKRAS変異型よりも野生型で高い抗腫瘍活性を示し、ORRは右側結腸で低かった。本試験は継続する価値が高いと考えられ、MyPathway試験は現在も登録中である。
(レポート:静岡県立静岡がんセンター 消化器内科 レジデント 川上 武志)

監修・レポーター
監修
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
レポーター
川上 武志先生
静岡県立静岡がんセンター 消化器内科 レジデント
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
成田 有季哉先生
愛知県がんセンター中央病院 薬物療法部 専門員
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
山口 敏史先生
国立がん研究センター中央病院 消化管内科 レジデント