2017年1月19日~21日に米国サンフランシスコにて開催された2017年 消化器癌シンポジウム(2017 Gastrointestinal Cancers Symposium)より、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には“Expert's view”として、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。
大腸癌
切除不能進行・再発大腸癌に対する2nd-lineとしてのXELIRI(+Bevacizumab)療法 vs. FOLFIRI(+Bevacizumab)療法の第III相試験における安全性解析(AXEPT試験)
A multinational, randomized, phase III trial of XELIR …
Masato Nakamura, et al.
Expert’s view

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
AXEPT試験は、FOLFIRI[+Bevacizumab(Bmab)]療法に対するXELIRI(+Bmab)療法の生存期間における非劣勢を検証する、アジア共同第III相試験であり、今回安全性に関する解析が報告された。
本試験で用いられたXELIRI[Capecitabine+Irinotecan(CPT-11)]療法の用量は、AIO0604試験1) やBIX試験2)で用いられた用量と同じであり、本試験よりもCapecitabineやCPT-11の用量が多いBICC-C試験3)で問題となった悪心、嘔吐、下痢、脱水などの消化器毒性の頻度は少なく、忍容性が良好なレジメンと考えられる。一方、FOLFIRI群と比較すると、grade 3/4の好中球減少の頻度は少なく、下痢の頻度が高かったことなどは、あらかじめ予想されていた範囲と考えられる。今回の報告は、あくまで安全性の報告に限られているが、本療法の忍容性が確認されたことより、今後有効性に関しても検証されれば、実臨床において有望な治療レジメンの1つとなるだろう。
同じく2nd-lineにおいて、経口フッ化ピリミジン系製剤であるS-1を用いたIRIS療法[S-1(80mg/m²/day, day 1-14)+CPT-11(125mg/m², day 1, 15), 4週毎]とFOLFIRI療法を比較したFIRIS試験4)では、IRIS群におけるgrade 3以上の下痢が20.5%、発熱性好中球減少が4.8%であり、下痢の頻度が比較的高いと報告されている。現在、切除不能進行・再発大腸癌1st-line例を対象に、用法・用量を調整したSIRB療法[S-1(80-120mg/day, day 1-14)+CPT-11(150mg/m², day 1)+Bmab(7.5mg/kg, day 1), 3週毎]およびIRIS+Bmab療法[S-1(80-120mg/day, day 1-14)+CPT-11(100mg/m², day 1, 15)+Bmab(5mg/kg, day1, 15), 4週毎]の有効性を検証するTRICOLORE試験5)が進行中であり、その結果も注目される。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
XELIRI+Bevacizumab併用療法
XELIRI療法は、切除不能進行・再発大腸癌において、様々な用法・用量で開発されてきた。BICC-C試験3)ではFOLFIRI療法と比較してXELIRI療法[Capecitabine(2000mg/m²/day, day 1-14)+CPT-11(250mg/m², day 1), 3週毎]で悪心、嘔吐、下痢、脱水などの消化器毒性の頻度が高く、有害事象による治療中止割合も高かった。その後、AIO0604試験(第II相試験)1)では、Capecitabine、CPT-11を減量したXELIRI療法[Capecitabine(1600mg/m²/day, day 1-14)+CPT-11(200mg/m², day 1), 3週毎]とBmab(7.5mg/kg, day 1, 3週毎)の併用療法における有効性、安全性が確認された。また、本邦においてもAIO0604試験と同用法・用量のXELIRI+Bmab療法の有効性、安全性がBIX試験(第I/II相試験)2)にて確認されている。
AXEPT試験
本試験は、切除不能進行・再発大腸癌既治療例に対するXELIRI(+Bevacizumab)の有効性を検証するために、日本、韓国、中国で行われたアジア共同オープンラベルの第III相無作為比較試験であり、今回、安全性解析結果が報告された。切除不能進行・再発大腸癌に対する2nd-lineを対象に、コントロール群[FOLFIRI群:bolus 5-FU(400mg/m², day 1)+infusional 5-FU(2400mg/m²)+CPT-11(180mg/m², day 1)+l-LV(200mg/m², day 1)+Bmab(5mg/kg, day 1), 2週毎]、試験治療群[XELIRI群:Capecitabine(1600mg/m²/day, day 1-14)+CPT-11(200mg/m², day 1)+Bmab(7.5mg/kg, day 1), 3週毎]に1:1で割り付けられた。両治療群において、UGT1A1*6ホモ、UGT1A1*28ホモ、UGT1A1*6*28ダブルヘテロの症例では、CPT-11の用量は150mg/m²に減量開始とされた。層別因子として、地域、ECOG PS、転移臓器個数、Oxaliplatin(L-OHP)の前治療歴の有無、Bmab併用の有無を用い、日本と韓国では、全例においてBmabを併用することがプロトコールで規定されていた。
主要評価項目はOS、副次評価項目はPFS、TTF(time to treatment failure)、奏効率、病勢コントロール率、相対用量強度、安全性、UGT1A1 phenotype別の安全性とであった。期待ハザード比を 1.00(両群のOS中央値12.6ヵ月)とし、非劣勢検証のハザード比の上限は1.30、両側α=0.05、検出力80%、登録期間24ヵ月、観察期間18ヵ月で、464イベントが必要であり、必要症例数は600例であった。
安全性解析結果
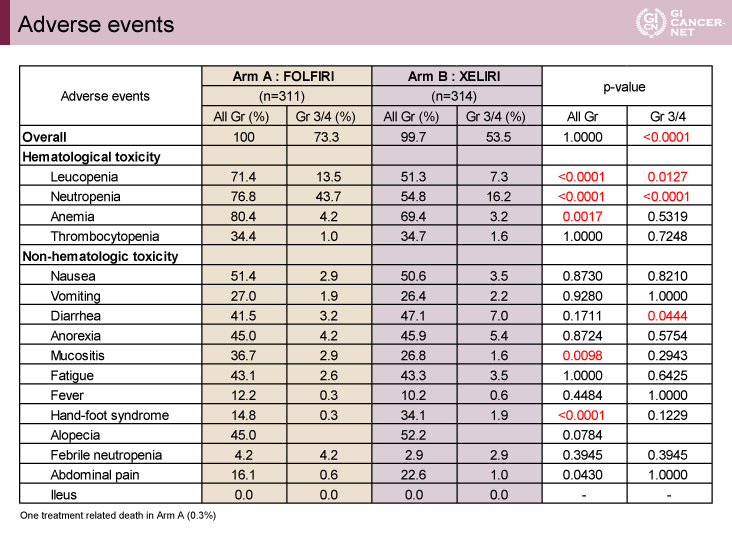
2013年12月~2015年8月の間に650例が登録され、FOLFIRI群324例、XELIRI群326例に割り付けられ、安全性の解析対象はそれぞれ311例、314例であった。患者背景は、FOLFIRI群/XELIRI群でそれぞれ、年齢中央値63歳/60.5歳、男性58.2%/60.5%、ECOG PS 0-1が99.4%/99.7%、転移臓器個数1個36.3%/37.3%、登録地域は日本、韓国、中国が42.1%/40.5%、35.0%/36.7%、22.8%/23.8%、L-OHPの前治療歴あり97.7%/98.1%、Bmab併用あり84.9%/83.9%、UGT1A1ダブルヘテロまたはホモが7.7%/7.3%であり、群間差を認めなかった。
全gradeの有害事象は、白血球減少(71.4 vs. 51.3%, p<0.0001)、好中球減少(76.8 vs. 54.8%, p<0.0001)、貧血(80.4 vs. 69.4%, p=0.0017)、粘膜炎(36.7 vs. 26.8%, p=0.0098)はFOLFIRI群で有意に多く、手足症候群(14.8 vs. 34.1%, p<0.0001)はXELIRI群で有意に多かった(表)。Grade 3/4の有害事象の頻度はFOLFIRI群で高く(73.3 vs. 53.5%, p<0.0001)、特に白血球減少(13.5 vs. 7.3%, p=0.0127)、好中球減少(43.7 vs. 16.2%, p<0.0001)はFOLFIRI群で有意に多く認めた。一方、XELIRI群では、下痢(3.2 vs. 7.0%, p=0.0444)を有意に多く認めた。
Bmabに関連したgrade 3/4の有害事象は、高血圧(10.2 vs. 7.3%, p=0.2802)、タンパク尿(0.0 vs. 0.0%)、出血(0.4 vs. 0.8%, p=0.6221)、静脈血栓症(1.1 vs. 0.4%, p=0.6236)、動脈血栓症(0.0 vs. 0.8%, p=0.2467)、消化管穿孔(0.0 vs. 0.4%, p=0.4971)のいずれも両群に差を認めず、既報と同様であった。
発表者の許可を得て掲載(approved by Masato Nakamura)
まとめ
XELIRI療法の有害事象プロファイルはFOLFIRI療法と異なるものの、忍容性は良好であった。また、Bevacizumabを併用しても両レジメンの安全性プロファイルは変わらなかった。
(レポート:愛知県がんセンター中央病院 薬物療法部 専門員 成田 有季哉)
Reference
- 1) Schmiegel W, et al.: Ann Oncol. 24(6): 1580-1587, 2013[PubMed]
- 2) Hamamoto Y, et al.: Oncologist. 19(11): 1131-1132, 2014[PubMed]
- 3) Fuchs CS, et al.: J Clin Oncol. 25(30): 4779-4786, 2007[PubMed]
- 4) Muro K, et al.: Lancet Oncol. 11(9): 853-860, 2010[PubMed]
- 5) Komatsu Y, et al.: BMC Cancer. 15: 626, 2015[PubMed]

監修・レポーター
監修
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
レポーター
川上 武志先生
静岡県立静岡がんセンター 消化器内科 レジデント
監修
山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
レポーター
成田 有季哉先生
愛知県がんセンター中央病院 薬物療法部 専門員
監修
谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
レポーター
山口 敏史先生
国立がん研究センター中央病院 消化管内科 レジデント