切除不能進行・再発大腸癌に対するCEA/CD3 T-cell bispecific (CEA-TCB) 抗体の単独療法またはAtezolizumab併用療法の第I相試験
Phase I studies of the novel carcinoembryonic antigen CD3 T-cell bispecific (CEA-TCB) antibody as a single agent and in combination with atezolizumab: preliminary efficacy and safety in patients with metastatic colorectal cancer (mCRC)
Josep Tabernero, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
大腸癌は免疫チェックポイント阻害剤による効果が弱く、いわゆる免疫的に“Cold”な癌であることが一般的認識である。大腸癌ではミスマッチ修復遺伝子欠損大腸癌を除いて遺伝子変異総数が少なく、免疫原性が低いため、腫瘍周囲への免疫細胞の浸潤が少ないことが、その主な原因とされている。2016年の米国臨床腫瘍学会年次集会で報告されたMEK阻害剤との併用や放射線との併用など、免疫反応性の低さを克服する試みがいくつかなされており、今回の試験もそのうちの1つである。
CEA-TCBは、CEAが高発現な大腸癌を認識する抗CEA抗体と、T細胞を認識する抗CD3抗体の組み合わせで、これにより半ば無理やり癌細胞の周囲にT細胞を呼び寄せようというアイデアである。最終的には免疫チェックポイント阻害剤であるAtezolizumabがPD-L1をブロックすることで抗腫瘍効果を発揮するのであるが、理詰めで考えられた併用デザインがヒトでも効果を発揮することを示したのがこの試験の面白いところで、第Ia/Ib相試験の少数例の検討ながらもOral Sessionに選ばれたのは、そのような背景があるのだろう。同様の手法を用いることで、“Cold”な癌を一転“Hot”に変えることができれば、免疫チェックポイント阻害剤のメリットである、比較的軽微な副作用(特徴的な副作用はあるものの)で長期の有効性が期待でき、さらに既存の薬剤との併用も可能となると、治療戦略の幅はさらに広がってくるものと考えられる。
毒性に注目すると、grade 3以上のinfusion reactionが40mg以上の単独療法で24%、併用療法で12%と比較的高率に認められているところは注意すべきであるが、今後の展開に注目が集まる薬剤である。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
腫瘍細胞抗原のCEAとT細胞のCD3を二重標的とする新たな抗体薬
CEA-TCB(RG7802、RO6958688)は、腫瘍細胞抗原であるCEAとT細胞上のCD3の両者に結合するドメインを有する新しい二重特異性抗体薬(bispecific antibody)である1)(図1)。CEA高発現の腫瘍が標的となることから、90%以上にCEA高発現を認める切除不能進行・再発大腸癌は良い対象であると考えられる2)。また、CEA-TCBは腫瘍細胞とT細胞を架橋し、T細胞を活性化させて細胞傷害を誘導するとともに、T細胞浸潤の増加を促し腫瘍の免疫原性を高める1)ため、元来免疫原性の弱い腫瘍においてもT細胞による細胞傷害が誘導される。さらに、T細胞のINFγ分泌により腫瘍内PD-L1がupregulateされる1)ことから、抗PD-L1抗体薬との併用により抗腫瘍効果が高まることが基礎実験で示されている3)。
今回、CEA高発現腫瘍に対するCEA-TCBの単独療法およびAtezolizumab併用療法の第I相試験が行われ、その安全性と切除不能進行・再発大腸癌に対する有効性の結果が報告された。
図1
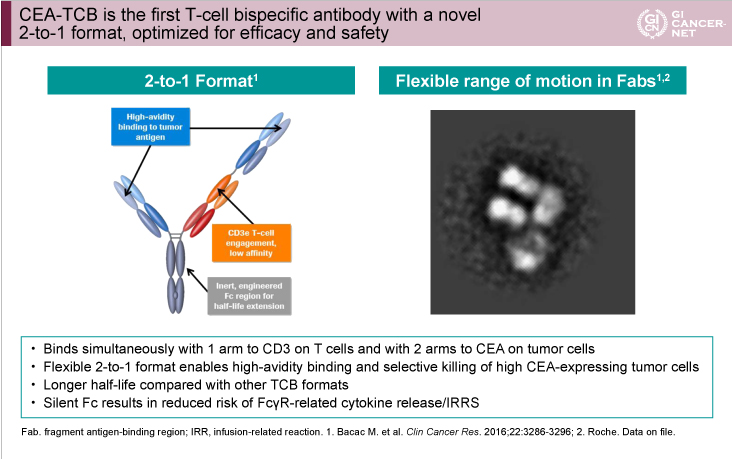
発表者の許可を得て掲載(approved by Josep Tabernero)
CEA高発現の腫瘍がターゲット
対象は、局所進行または遠隔転移を有し、標準治療不応・不耐、ECOG PS 0/1、CEA高発現(免疫組織染色で20%以上の腫瘍細胞がmoderate~highのCEA発現)の固形癌患者である。Study 1(単独療法)では単回投与試験(Part I)と反復投与試験(Part II)、Study 2(Atezolizumab併用)では反復投与試験が行われた。なお、CEA-TCBは1週毎、Atezolizumabは1,200mgを3週毎に投与された。
全体でStudy1: 80例、Study 2: 45例のCEA高発現固形癌患者 が登録され、そのうち大腸癌患者はStudy 1: 70例(Part I: 5例、Part II: 65例)、Study 2: 35例であった。今回、全登録患者が安全性の解析対象となったが、大腸癌患者のうち、①Study 1のPart IIで60~600mgのCEA-TCBが投与された31例、②Study 2で5~160mgのCEA-TCBが投与された25例が有効性の解析対象となった。
安全性プロファイル
単独療法、併用療法ともに、infusion reactionと下痢を高頻度に認めたが、いずれも管理可能であった(表1)。Study 1では5例に用量制限毒性(DLT)(grade 3の呼吸困難、低酸素、下痢、grade4の大腸炎、grade5の呼吸不全)を認め、Study 2では2例にDLT(grade3のALT上昇、皮疹)が認められた。
表1
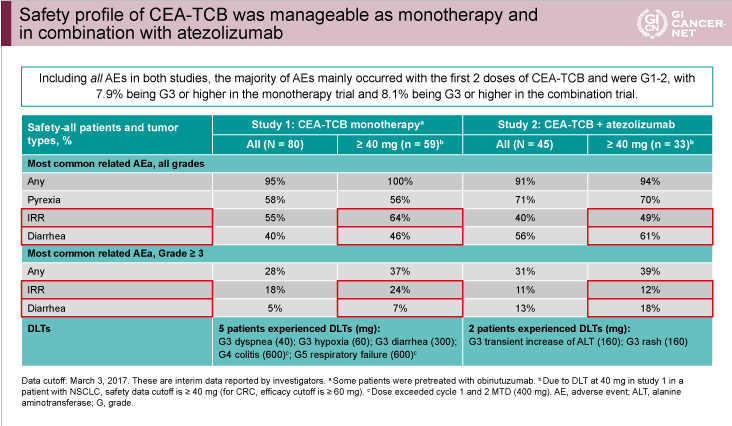
発表者の許可を得て掲載(approved by Josep Tabernero)
単独療法、併用療法ともにMSS大腸癌で有効性を示した
有効性の解析対象となった大腸癌患者の患者背景では、マイクロサテライト安定性(MSS)症例(Study 1: 90%、Study 2: 92%) 、3レジメン以上の前治療歴を有する症例(Study1: 61%、Study 2: 68%)が多く認められた(表2)。
表2
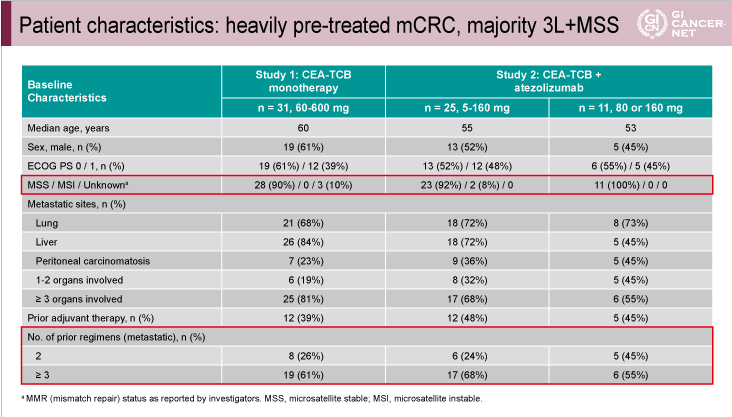
発表者の許可を得て掲載(approved by Josep Tabernero)
単独療法、併用療法の結果、いずれも60mg以上のCEA-TCBが投与された症例において抗腫瘍効果が示された(図2)。
図2
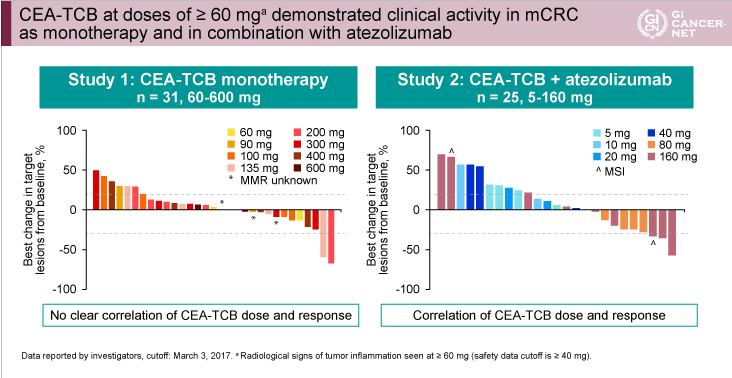
発表者の許可を得て掲載(approved by Josep Tabernero)
単独療法(CEA-TCB 60~600mg)を行った31例(MSS: 28例、不明: 3例)における奏効率は6%、病勢コントロール率は45%であった(表3)。また、併用療法(CEA-TCB 5~160mg)を行った25例 (MSS: 23例、MSI: 2例)における奏効率は12%、病勢コントロール率は52%であり、そのなかでも80mgまたは160mgのCEA-TCBが投与された11例(全例MSS)では奏効率18%、病勢コントロール率82%と高い抗腫瘍効果を認め、spider plotにおいても長期にわたる病勢コントロールが示された(図3)。
表3
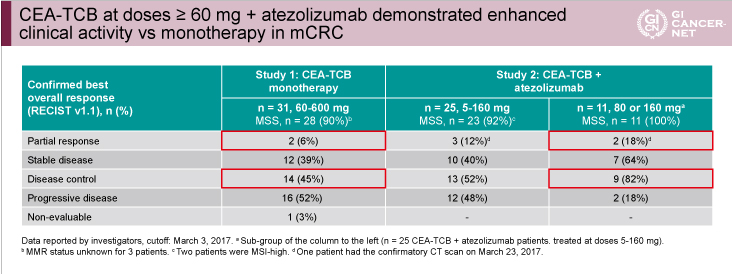
発表者の許可を得て掲載(approved by Josep Tabernero)
図3
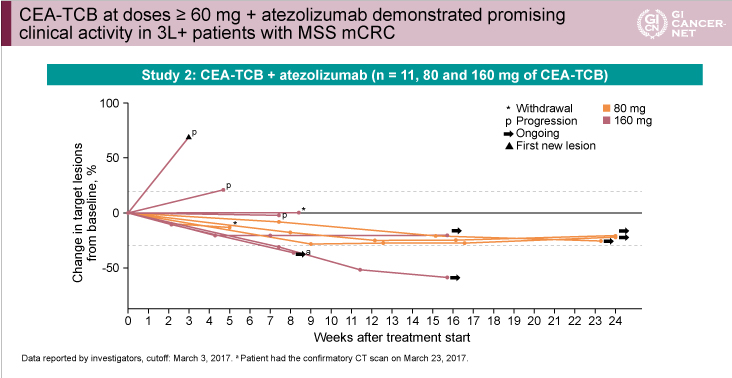
発表者の許可を得て掲載(approved by Josep Tabernero)
まとめ
CEA-TCBは単独療法、Atezolizumabとの併用療法において、忍容可能な安全性プロファイルを示し、CEA高発現の切除不能進行・再発大腸癌に対して有望な抗腫瘍効果を示した。特に、Atezolizumabとの併用療法はMSS大腸癌に対する高い抗腫瘍効果が期待できる。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 診療助手 新井 裕之)
References
1) Bacac M, et al.: Clin Cancer Res. 22(13): 3286-3297, 2016[PubMed]
2) Tieman JP, et al.: Br J Cancer. 108(3): 662-667, 2013[PubMed]
3) Bacac M, et al.: AACR 2017. abstr #1494
関連リンク
大腸癌に対するCobimetinib + Atezolizumab併用療法の有効性と安全性[学会レポート]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師