原発巣の部位は分子生物学的にも切除不能進行・再発大腸癌におけるOSの独立した予後因子である
Primary tumor location is an independent prognostic marker from molecular features for overall survival in patients with metastatic colorectal cancer: Analysis of CALGB/SWOG 80405 (Alliance).
Alan P. Venook, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
今回の解析を通じて、原発巣の左右の違いと予後の関係は、現時点で予後と関わるとされるマイクロサテライト不安定性(MSI)、BRAF、NRAS、KRAS、HRAS変異といったmolecular markerとは関係のない、それ自体が独立した因子であることが明らかとなった。発生学的に左側結腸は後腸由来なのに対し、右側結腸は中腸由来であり、そもそも由来の異なる臓器である。そのため、右側と左側の腫瘍は腫瘍生物学的に異なる可能性があると言われ続けているが、何がその違いを規定しているのかは依然として不明である。
今回のCALGB80405試験の検体を用いたさらなる解析が現在進行中であり(次世代シーケンサーを用いた 腫瘍DNAの全エクソームシーケンスや腫瘍RNAのRNAシーケンスの解析、血中遊離腫瘍DNA、高メチル化)、その結果に注目が集まる。また、現在進行中の初回治療例に対するBevacizumab併用療法と抗EGFR抗体薬併用療法の直接比較試験である、現在進行中の本邦のPARADIGM試験1)や計画中のスペインのTTDグループを中心とした臨床試験の結果およびトランスレーショナル研究において、原発巣の部位の背景に潜む真実が明らかにされることを期待したい。また、その際には分子生物学的な検討だけではなく、microbiomeやTIL(tumor infiltrating lymphocyte)といった免疫環境との関係にも注目したい。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
切除不能進行・再発大腸癌原発巣の左右の違いは予後因子かつBevacizumabもしくはCetuximab+化学療法の治療効果の予測因子である
CALGB80405試験では、KRAS野生型の切除不能進行・再発大腸癌に対する1st lineにおいて、作用機序の異なる分子生物学的製剤であるBevacizumabまたはCetuximabを化学療法(FOLFOX/FOLFIRI)に併用してもOSやPFSに差がないことが示されている。2016年の米国臨床腫瘍学会年次集会で発表された追加解析では、左側結腸例(732例, 68%)が右側結腸例(293例, 27%)に比べて、有意に良好なOS(p<0.0001)、PFS(p=0.0006)を認め、原発巣の左右の違いがOSにおいて有意な交互作用を持つことが示された(注: 横行結腸症例66例は解析から除外された)。原発巣の部位が右側に比べて左側で予後が良好であるという結果は、最近のメタアナリシスでも認められており2)、本試験から得られた知見は確からしいと考えられている。
加えて、CALGB80405試験の追加解析では、原発巣の左右の違いはBevacizumabおよびCetuximabのいずれにおいても予後因子かつ効果予測因子であることが示されている。
原発巣の左右はmolecular markerによる調節後も依然として独立した予後因子である
今回、molecular markerで調節した場合における原発巣の左右の違いについて、Cox比例ハザードモデルを用いた多変量解析にて検討した。
放射線治療歴、術後補助化学療法歴の有無により層別化され、年齢、人種、性別、同時性もしくは異時性転移、CMS(Consensus Molecular Subtype)*、マイクロサテライト不安定性(MSI)、およびBRAF、NRAS、KRAS、HRAS変異状況により調整された結果、原発巣の左右の違いは依然として独立した予後因子であった(HR=1.392, 95% CI: 1.032-1.878, p=0.031)。
*CMS:従来の遺伝子発現に基づいた大腸癌の分類に見られる矛盾点を解決し、トランスレーショナル研究を促進するために、2015年に提唱された概念。大規模データの共有と多様な専門分野の研究者による分析を目的とした国際コンソーシアムによって、6つの独立した分類システム間で、相互に顕著なつながりを持ち、かつ際立った特徴を持つ4つのコンセンサス分子サブタイプ(CMS; consensus molecular subtype)がまとめられた3)。
原発巣の左右の予後に腫瘍量の影響は認めなかったが、転移形式は異なる可能性がある
原発巣の左右の違いが独立した予後因子となる理由は不明だが、1つの仮説として、「右側結腸では腫瘍量が多いことから予後不良である」というものがある。右側結腸では症状の出現が遅いため発見時には腫瘍量が多くなるという仮説であり、今回は本仮説についての検討も行った。しかし、腫瘍量に関わると考えられる因子[LDH、転移臓器数、術後補助化学療法歴の有無、原発巣の有無、治療目的(延命 vs. 治癒)]において、原発巣の左右で明らかな差は見出せなかった(表)。一方、転移パターンについては差が認められ、左側では有意に肝転移が多かった。したがって、右側で予後不良である理由は、腫瘍の持つ生物学的違いに由来すると考えられる。
表
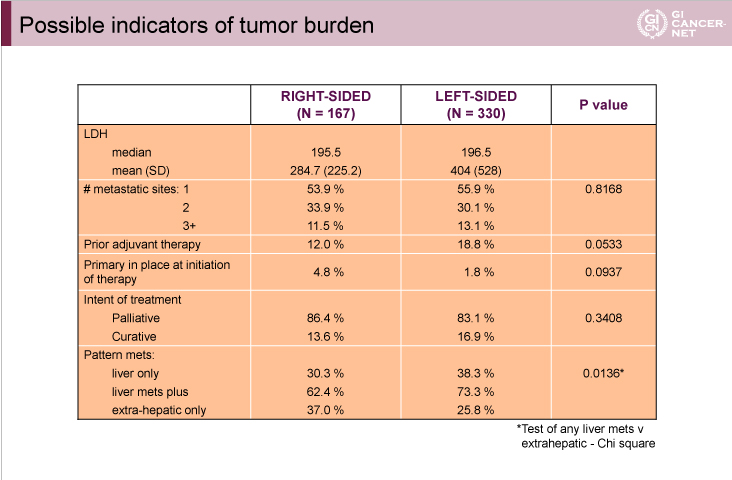
発表者の許可を得て掲載(approved by Alan P. Venook)
まとめ
様々なmolecular markerによる調整後においても、原発巣の左右の違いは独立した予後因子であった。したがって、原発巣の左右は大腸癌の臨床研究において層別化因子とすべきである。原発巣の左右の違いは依然として独立した予後因子であるが、そのメカニズムを明らかにすべく、さらなる研究が必要である。
(レポート:近畿大学医学部 内科学腫瘍内科部門 医学部講師 川上 尚人)
References
1) Panitumumab and RAS, DIagnostically-useful Gene Mutation for mCRC. (PARADIGM) [CT.gov]
2) Holch JW, et al.: Eur J Cancer. 70: 87-98, 2017[PubMed]
3) Guinney J, et al.: Nat Med. 21(11): 1350-1356, 2015[PubMed]
関連リンク
切除不能進行・再発大腸癌における原発巣部位によるOS、PFSへの影響[学会レポート]
大腸癌サブタイピングコンソーシアム(CRCSC)による大腸癌分子サブタイプのコンセンサス結果[学会レポート]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師