CMS(Consensus Molecular Subtyping)が1st-line大腸癌化学療法の治療効果に与える影響(FIRE-3試験とCALGB80405試験から)
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
今回、FIRE-3試験とCALGB80405試験という異なる2試験からCMS(Consensus Molecular Subtype)*に基づいて得られた結果は、両試験に共通するものと異なるものとに大きく分かれた。
両試験に共通するのは、CMSの各サブタイプの割合およびその左右における分布である。本検討では2試験で同様の解析方法を用いており、遺伝子発現を収集するassayが異なっていても解析方法が同じであれば、得られる結果の信頼性が高い可能性があると言える。また、異なる2試験ではあったが、分子生物学的な患者背景は比較的揃っていたと考えられる。CMSと予後との関係についても、2試験およびGuinneyらによるstage II/IIIでの解析結果1)はほぼ共通しており、切除不能進行・再発大腸癌においてもCMSが予後因子として機能することが示された。ただ、本検討はいずれもRAS野生型を対象としていることから、過去の報告と比較してCMS2の頻度が高くなり、各サブタイプの割合が異なることには注意が必要である。
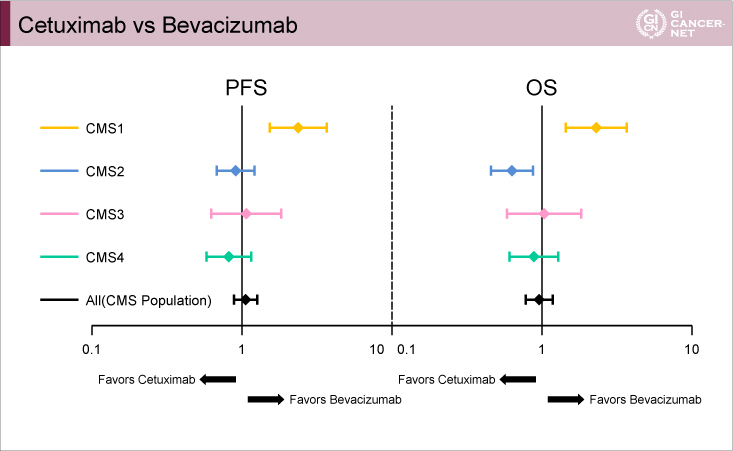
一方で、CMSと治療効果との関係については2試験間で大きく異なる結果となった。CALGB80405試験でみられたCMS1とBevacizumabの関係、FIRE-3試験でみられたCMS4とCetuximabとの関係は、それぞれ再現されることがなかった。上述したようにCMSによる患者背景は比較的一致していたと考えられる一方でこのような不一致が生じた理由は不明だが、CMSが予後因子としての信頼度が高くても効果予測因子としては不十分である可能性が示唆される。
例えば、マイクロサテライト不安定性(MSI-H)がBevacizumabの効果予測因子である可能性については本年次集会の#3504において示されている。CMS1はMSIに代表されるサブタイプであるが、真のMSI-Hは既報から4%程度であると考えられる。本検討におけるCMS1症例は15~18%であることから、CMS1であるがMSI-Hではない症例が10数%存在しており、それらのBevacizumabに対する治療効果は不明である。
さらに、今回のFIRE-3試験とCALGB80405試験におけるCMS1の背景の違いとして、年齢が挙げられる。前者においてはCMS1が全体より若い集団であったのに対し、後者では高齢な集団であった。MSI-Hの機序としてgermline mutationからなるいわゆるリンチ症候群と高メチル化からなるsporadic MSIがあるが、前者は若年で後者は高齢であることが知られている。同じMSI-Hであってもリンチ症候群ではBRAF変異を有さないのに対して、高メチル化によって生じるMSI-Hではその40%にBRAF変異を合併する。したがって、同じCMS1であっても若年者と高齢者とでは異なる生物学的特徴(特にBevacizumabに対して)を有している可能性は否定できない。
以上のように、同じCMSのなかでも異なる特徴を持った集団が混在している可能性がある。現在および新たな治療の効果予測因子およびターゲットとしての有用性に関しては、今後さらなる検討が必要であると考える。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
*CMS:従来の遺伝子発現に基づいた大腸癌の分類に見られる矛盾点を解決し、トランスレーショナル研究を促進するために、2015年に提唱された概念。大規模データの共有と多様な専門分野の研究者による分析を目的とした国際コンソーシアムによって、6つの独立した分類システム間で、相互に顕著なつながりを持ち、かつ際立った特徴を持つ4つのコンセンサス分子サブタイプ(CMS; Consensus Molecular Subtype)がまとめられた(表1)1)。
表1

発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
#3510
Consensus molecular subgroups (CMS) of colorectal cancer (CRC) and 1st-line efficacy of FOLFIRI plus Cetuximab or Bevacizumab: Analysis of the FIRE-3 (AIO KRK-0306) study.
Sebastian Stintzing, et al.
#3511
Impact of consensus molecular subtyping (CMS) on overall survival (OS) and progression free survival (PFS) in patients (pts) with metastatic colorectal cancer (mCRC): Analysis of CALGB/SWOG 80405 (Alliance).
Heinz-Josef Lenz, et al.
FIRE-3試験とCALGB80405試験でCMSの分布はほぼ共通
CMS(Consensus Molecular Subtyping)は腫瘍生物学に焦点をあて提唱された概念であるが、予後予測的なバイオマーカーとなることが知られている1)。ただ、CMSの基となっているデータの大部分がstage II/III大腸癌からのものであり、切除不能進行・再発大腸癌におけるCMSの意義は不明であった。
FIRE-3試験は、KRAS exon 2野生型の切除不能進行・再発大腸癌患者に対するFOLFIRI+CetuximabとFOLFIRI+Bevacizumabを比較した第III相試験であり、CALGB80405試験は、同様の対象でFOLFOX/FOLFIRI+CetuximabとFOLFOX/FOLFIRI+Bevacizumabを比較した第III相試験である。今回、RAS野生型症例のうち遺伝子発現解析が可能であったFIRE-3試験の315例、CALGB80405試験の581例について、CMSの4つのサブタイプにそれぞれ分類し、CMSの予後因子および効果予測因子としての意義を検討した。なお、発現遺伝子の情報は、FIRE-3試験の検体はAffymetrix、CALGB80405試験の検体はNanoStringから得られたが、データ解析はいずれもSIB(Swiss Institute of Bioinformatics)により行われた。
その結果、FIRE-3試験(図1)、CALGB80405試験(図2)におけるCMS各サブタイプの割合は、ほぼ同様であった。
図1 FIRE-3試験
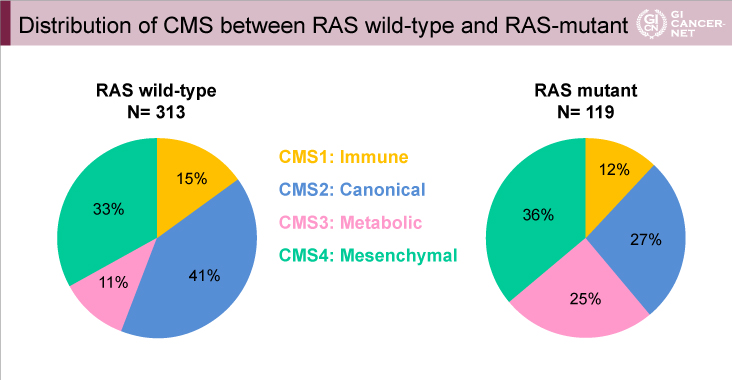
発表者の許可を得て掲載(approved by Sebastian Stintzing)
図2 CALGB80405試験
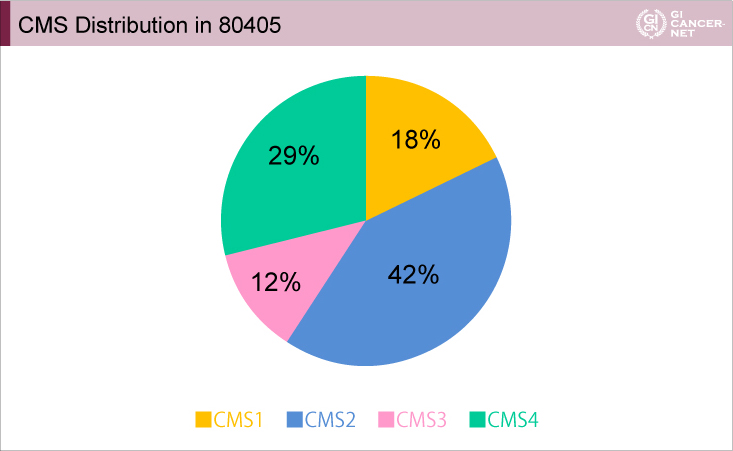
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
CMSと原発巣の左右との関係は、FIRE-3試験の右側がCMS1 27%、CMS2 28%、CMS3 10%、CMS4 35%、左側がCMS1 11%、CMS2 45%、CMS3 12%、CMS4 32%、CALGB80405試験の右側がCMS1 37%、CMS2 23%、CMS3 12%、CMS4 28%、左側がCMS1 9%、CMS2 48%、CMS3 13%、CMS4 30%であり、これも両試験間で分布はほぼ共通していた。
両試験の患者背景を以下に示す(FIRE-3試験: 表2、CALGB80405試験: 表3)。両試験間にはCMS1の年齢について違いがみられ、FIRE-3試験における年齢中央値は解析対象全体64歳に対してCMS1 59歳と若く、CALGB80405試験では全体60.1歳に対してCMS1は64.1歳と高齢であった。
表2 FIRE-3試験
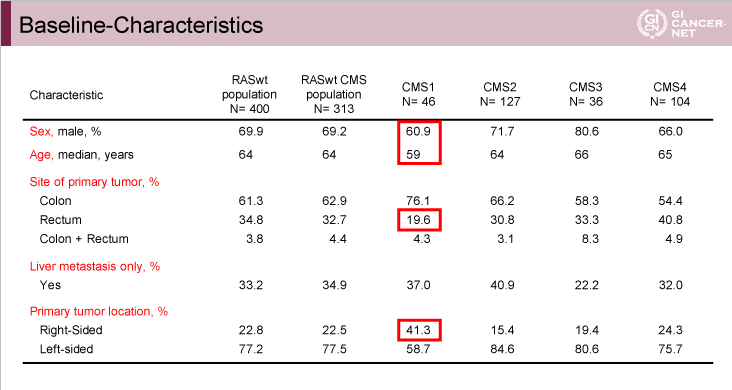
発表者の許可を得て掲載(approved by Sebastian Stintzing)
表3 CALGB80405試験
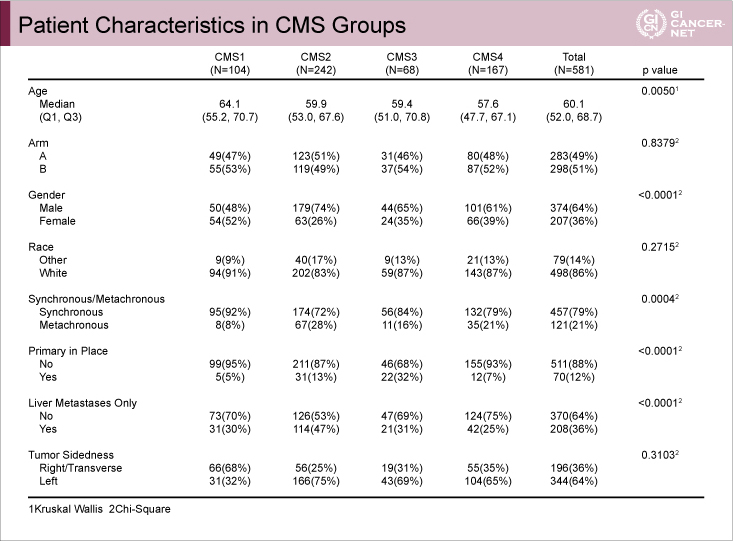
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
CMSは予後因子である
両試験のCMS分類によるPFSおよびOSのデータを以下に示す(FIRE-3試験:図3、CALGB80405試験:図4、図5)。FIRE-3試験、CALGB80405試験のいずれにおいても、PFS、OSともにCMS2が最も良好でCMS1が最も不良であった。一方、CMS3とCMS4は、FIRE-3試験ではほぼ同様であったが、CALGB80405試験ではCMS4がCMS3より良好であった。CMSと予後との関係はGuinneyらの報告1)とほぼ一致しており、切除不能進行・再発大腸癌においてもCMSが予後因子となり得ることが示唆された。
図3 FIRE-3試験
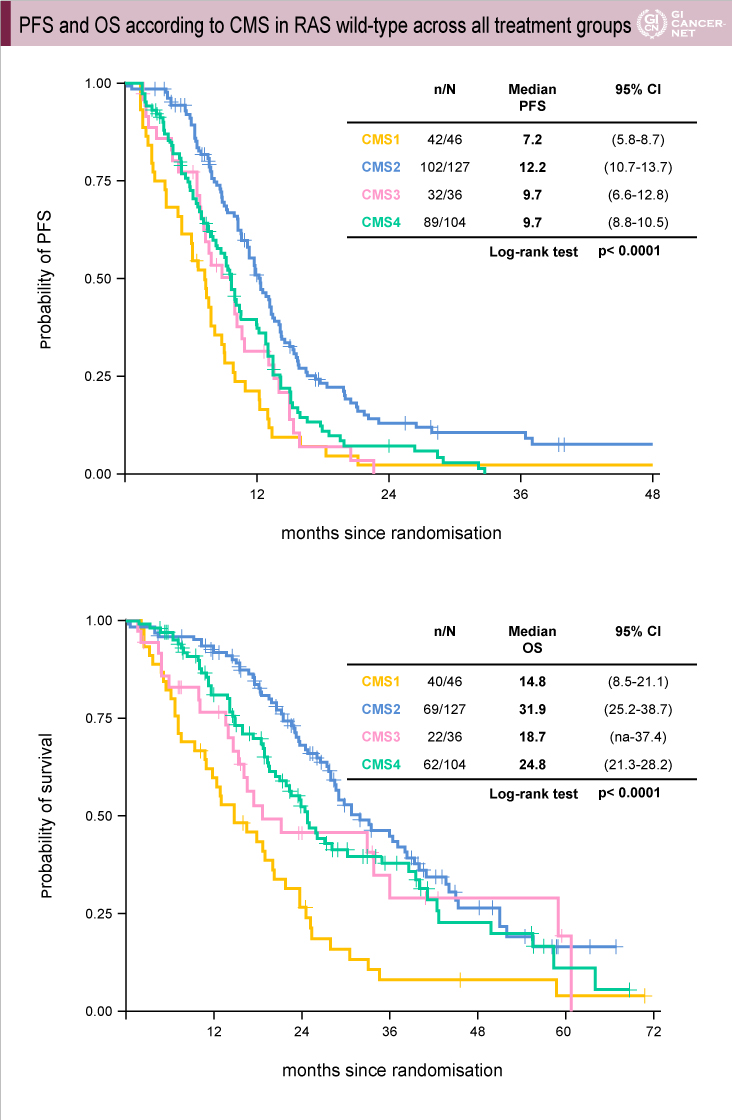
発表者の許可を得て掲載(approved by Sebastian Stintzing)
図4 CALGB80405試験
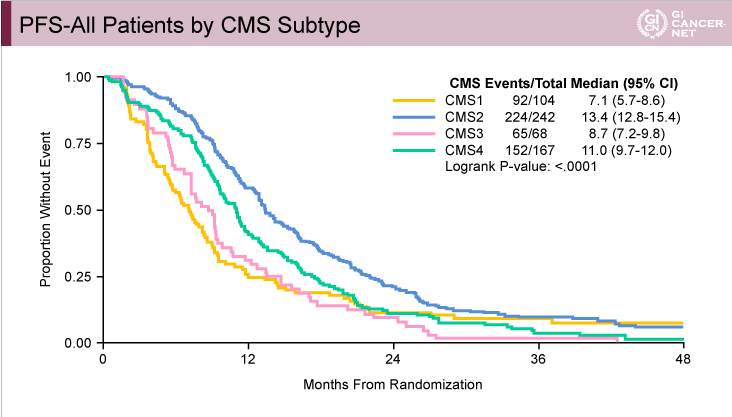
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
図5 CALGB80405試験
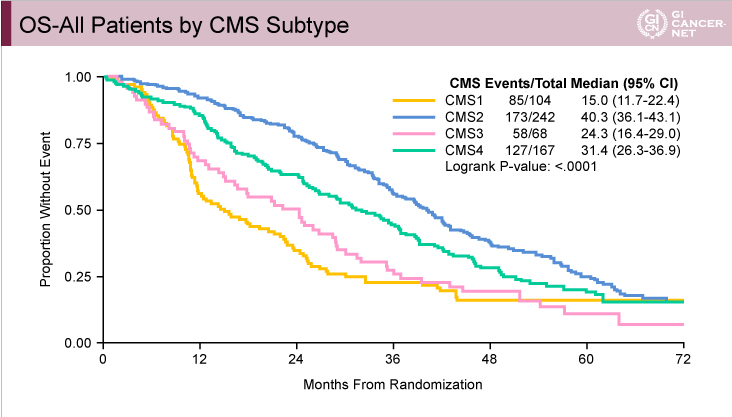
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
FIRE-3試験におけるCMSと治療レジメンとの関係:CMS4でCetuximabの治療効果
FIRE-3試験の主要評価項目である奏効率については、CMS2およびCMS4においてCetuximab群がBevacizumab群と比べて有意に良好であった(CMS2: 86.7% vs. 70.0%, p=0.045、CMS4: 77.8% vs. 53.2%, p=0.017)(図6)。
図6
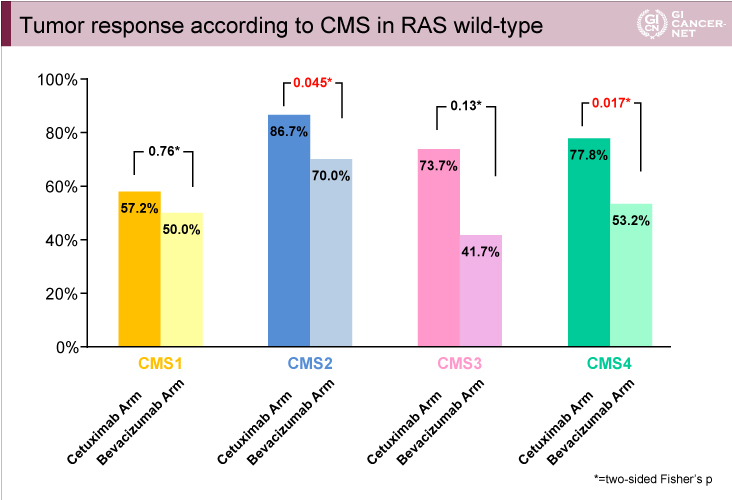
発表者の許可を得て掲載(approved by Sebastian Stintzing)
PFSおよびOSについては、CMS1、CMS2、CMS3では両群間に明らかな差を認めなかったが、CMS4ではPFS、OSともにCetuximab群がBevacizumab群と比べて有意に良好であった(図7、図8)。
以上のように、FIRE-3試験ではCMS4においてCetuximabによる治療効果が認められ、CMS4がCetuximabの効果予測因子である可能性が示唆された。
図7
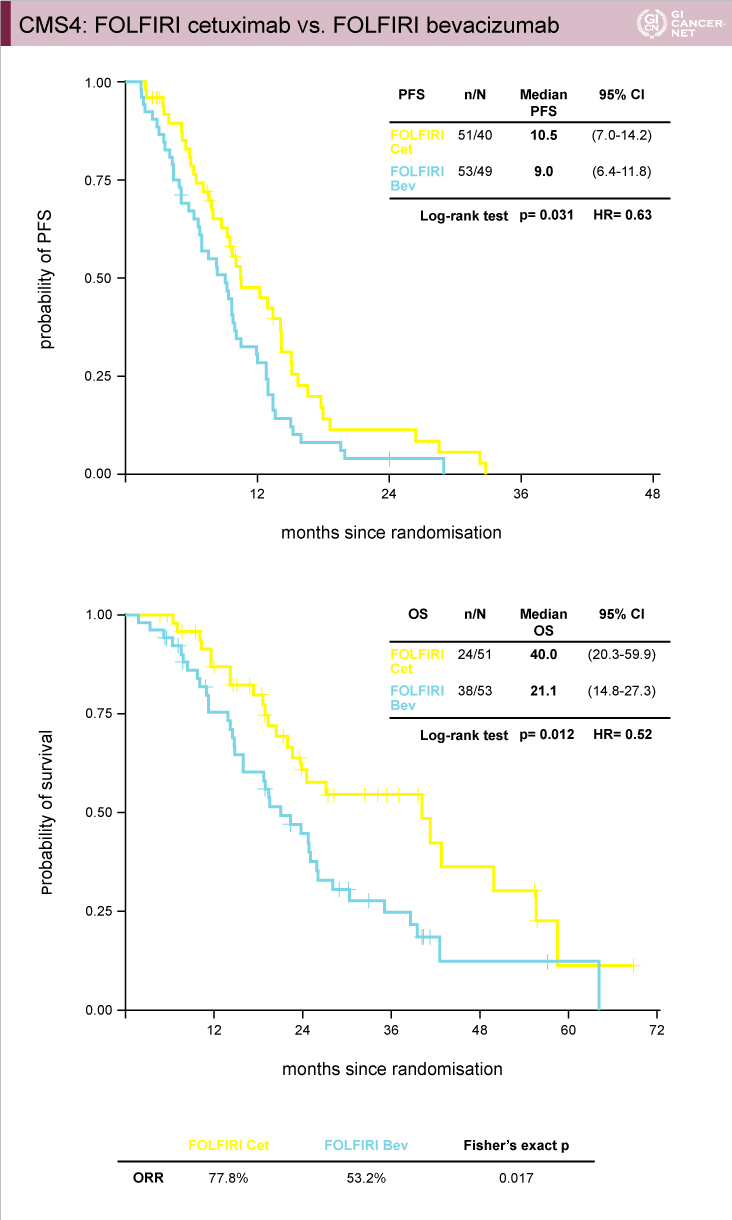
発表者の許可を得て掲載(approved by Sebastian Stintzing)
図8
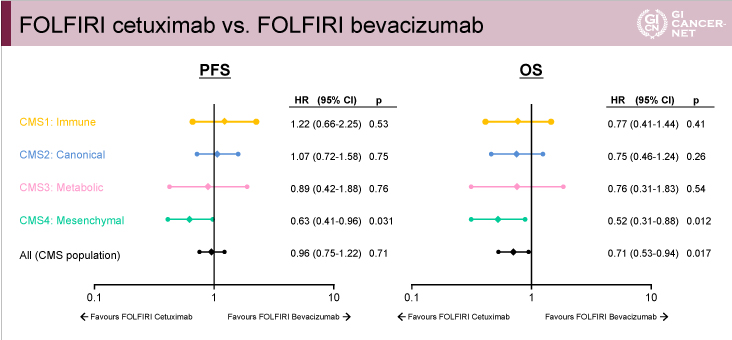
発表者の許可を得て掲載(approved by Sebastian Stintzing)
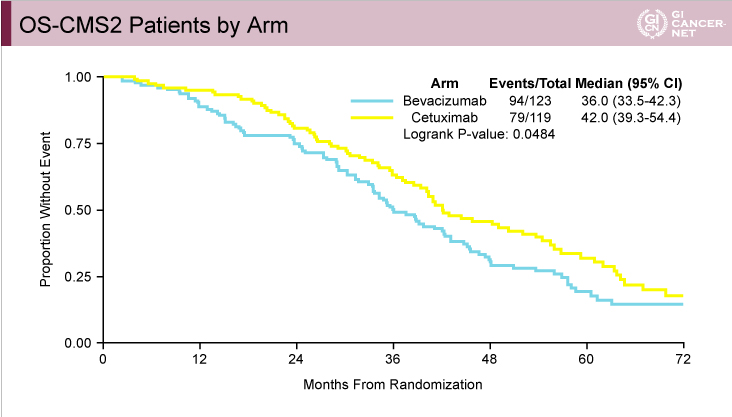
CALGB80405試験におけるCMSと治療レジメンとの関係:CMS1でBevacizumabの治療効果
CALGB80405試験ではFIRE-3試験と異なり、CMS1においてPFS(図9)、OS(図10)ともにBevacizumab群がCetuximab群と比べて有意に良好であった。また、CMS2においてはPFSでは有意差を認めなかったもののOSではCetuximab群が有意に良好であった(図11、図12)。
図9
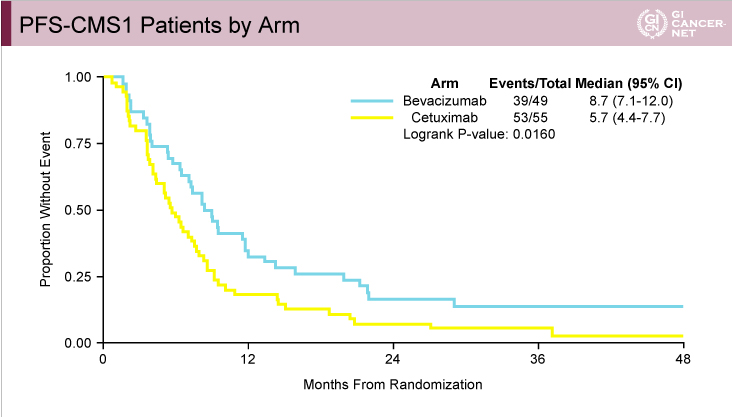
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
図10
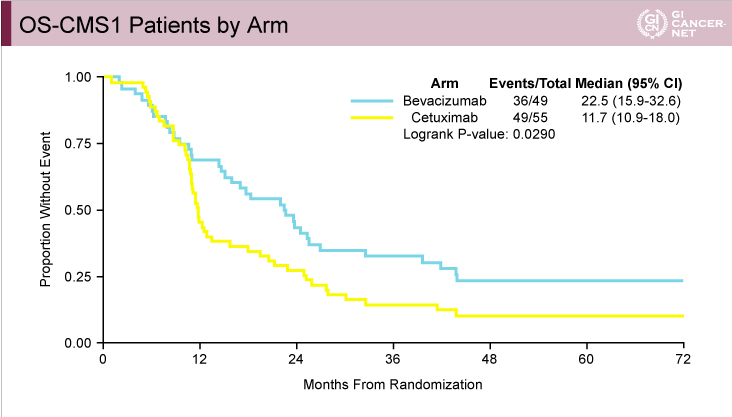
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
図11
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
図12
発表者の許可を得て掲載(approved by Heinz-Josef Lenz)
まとめ
両試験におけるCMS分類によるPFS、OSは同様の傾向を認め、CMS分類が切除不能進行・再発大腸癌においても予後因子であることが示唆された。一方でCetuximabとBevacizumabによる治療効果との関連性についてはやや異なっており、さらなる探索が必要である。
(レポート:近畿大学医学部 内科学腫瘍内科部門 医学部講師 川上 尚人)
Reference
1) Guinney J, et al.: Nat Med. 21(11): 1350-1356, 2015[PubMed]
関連リンク
KRAS野生型の切除不能進行・再発大腸癌に対するFOLFIRI/mFOLFOX6+Bevacizumab vs. FOLFIRI/mFOLFOX6+Cetuximabの第III相試験(CALGB/SWOG 80405)[学会レポート]
FIRE-3試験におけるKRAS/NRASおよびBRAF変異の解析:KRAS exon 2野生型の切除不能進行・再発大腸癌に対する1st-lineとしてのFOLFIRI+CetuximabおよびFOLFIRI+Bevacizumabの無作為化第III相試験[学会レポート]
大腸癌サブタイピングコンソーシアム(CRCSC)による大腸癌分子サブタイプのコンセンサス結果[学会レポート]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師