切除不能肝細胞癌初回治療例に対するLenvatinib療法とSorafenib療法の第III相臨床試験(REFLECT試験)
A phase 3 trial of Lenvatinib vs Sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma (REFLECT study)
Ann Lii Cheng, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
REFLECT試験は、切除不能肝細胞癌初回治療例を対象にSorafenib療法に対するLenvatinib療法の非劣性を検証した第III相臨床試験である。主要評価項目であるOS(overall survival)の非劣性が示され、副次評価項目であるPFS(progression-free survival)、TTP(time to progression)、奏効率はLenvatinib群で有意に良好な結果であった。ディスカッサントが指摘していたように、非劣性デザインの試験において試験治療群が標準治療とみなされるためには、“less toxic”、“less costly”、“easier to administer”であることが必要である。両薬剤ではgrade 3/4の高血圧、蛋白尿、食欲不振、体重減少はLenvatinib群で多い一方、手足症候群はSorafenib群で多かった。このように副作用プロファイルが異なることから、いずれの薬剤が”less toxic”であるかを結論づけることは難しく、個々の患者、医師の判断に委ねられると考える。一方、Lenvatinib群で認めた高い奏効率を考慮すると、腫瘍随伴症状を有しているなど腫瘍の縮小を期待したい症例は、本療法の良い対象になると思われる。
現在、Sorafenib不応例に対するRegorafenibの承認申請中であり、さらに肝細胞癌領域でも免疫チッェクポイント阻害薬の有望な結果が報告されている1)。これらの薬剤の適切なシークエンスの仕方、および併用療法、バイオマーカーの開発など多くの課題が残っており、今後の治療開発に期待したい。
(コメント・監修:静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
Lenvatinibとは?
全身化学療法が適応となる切除不能肝細胞癌において、初回化学療法はSorafenibが唯一の標準治療である2-5)。一方、Lenvatinibは、VEGF受容体、FGF受容体、PDGF受容体、RET、 KITを阻害することで、腫瘍における血管新生を抑制し、抗腫瘍効果を発揮するチロシンキナーゼ阻害剤であり、現在、根治切除不能な甲状腺癌で広く用いられている。Lenvatinibは肝細胞癌における第II相試験で有効性と安全性が確認されており6)、今回、Sorafenib療法に対するLenvatinib療法の非劣性を検証した第III相試験(REFLECT試験)の結果が報告された。
Sorafenib療法に対するLenvatinib療法の非劣性を検証
本試験の主な選択基準は、前治療歴のない、modified RECIST(mRECIST)における測定可能病変がある、BCLC(Barcelona Clinic Liver Cancer) stage B/C、Child-Pugh A、ECOG PS 0-1の切除不能肝細胞癌患者であった。対象患者は、Lenvatinib群[8mg(体重60kg未満)または12mg(体重60kg以上), 1日1回内服]とSorafenib群(400mg, 1日2回内服)に1:1で無作為に割り付けられた。
主要評価項目はOS、副次評価項目はPFS、TTP、奏効率、QOL、LenvatinibのPKであり、腫瘍評価には担当医判断によるmRECISTが採用された。なお、層別化因子として、地域、MVI(macroscopic portal vein invasion)、EHS(extrahepatic spread)、ECOG PS、体重が用いられた。両側α=0.05、ハザード比の非劣性マージンを1.08とし、700例の死亡イベントが必要とされた。
Lenvatinib療法のOSにおける非劣性、PFSにおける優越性が認められた
954例が登録され、Lenvatinib群478例、Sorafenib群476例に割り付けられた。主な患者背景(Lenvatinib群/Sorafenib群)は、年齢中央値が61.3歳/61.2歳、男性が85%/84%、地域(欧米)が33%/33%、体重(60kg未満)が32%/31%、ECOG PS 0が64%/63%、MVI・EHSが69%/71%、Child-Pugh Aが99%/99%、BCLC stage Bが22%/19 %、治療前のAFP値(200 ng/mL未満)が53%/60%であり、群間差を認めなかった。
主要評価項目であるOSの中央値は、Lenvatinib群13.6ヵ月(95% CI: 12.1-14.9)、Sorafenib群12.3ヵ月(95% CI: 10.4-13.9)であり(HR=0.92, 95% CI: 0.79-1.06)、ハザード比の95%信頼区間の上限が非劣性マージンの1.08を下回り、Sorafenib療法に対するLenvatinib療法の非劣性が認められた(図1)。
図1
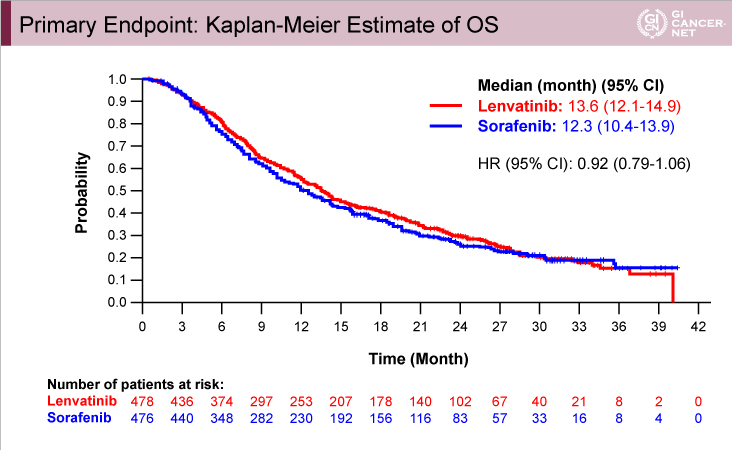
発表者の許可を得て掲載(approved by Ann Lii Cheng)
OSにおけるサブグループ解析ではLenvatinibが明らかに効きにくい集団はないことが確認された。治療前のAFP値200ng/mL未満におけるOS中央値はLenvatinib群19.5ヵ月(95% CI: 15.0-22.4)、Sorafenib群16.3ヵ月(95% CI: 14.2-18.8)であり(HR=0.91, 95% CI: 0.74-1.12)、200ng/mL以上ではLenvatinib群10.4ヵ月(95% CI: 8.7-12.0)、Sorafenib群8.2ヵ月(95% CI: 7.0-9.7)であった(HR=0.78, 95% CI: 0.63-0.98)。
mRECISTによるPFSの中央値は、Lenvatinib群7.4ヵ月(95% CI: 6.9-8.8)、Sorafenib群3.7ヵ月(95% CI: 3.6-4.6)であり(HR=0.66, 95% CI: 0.57-0.77, p<0.00001)、Lenvatinib群で有意に良好であった(図2)。
図2
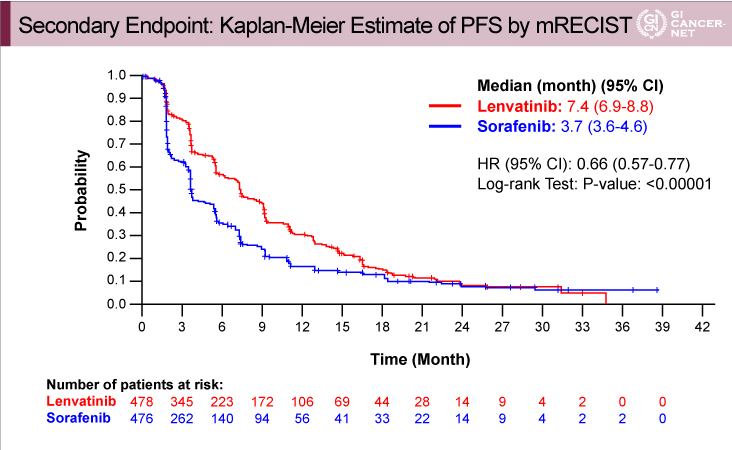
発表者の許可を得て掲載(approved by Ann Lii Cheng)
TTPの中央値は、Lenvatinib群8.9ヵ月(95% CI: 7.4-9.2)、Sorafenib群3.7ヵ月(95% CI: 3.6-5.4)であり(HR=0.63, 95% CI: 0.53-0.73, p<0.00001)、Lenvatinib群で有意に良好であった。奏効率は、Lenvatinib群24.1%(95% CI: 20.2-27.9)、Sorafenib群9.2%(95% CI: 6.6-11.8)であり(Odds ratio=3.13, 95% CI: 2.15-4.56, p<0.00001)、CRをそれぞれ1.3%、0.4%に認めた。相対用量強度は、Lenvatinib群8mgが87.7%、12mgが87.5%、Sorafenib群83.0%であった。
有害事象とQOL
Lenvatinib群/Sorafenib群におけるGrade 3以上の治療関連有害事象は、57%/49%であった。Grade 3/4の主な治療関連有害事象は、高血圧(23%/14%)、下痢(4%/4%)、食欲低下(5%/1%)、疲労(4%/4%)、手足症候群(3%/11%)、蛋白尿(6%/2%)、血小板減少(6%/3%)、AST上昇(5%/8%)であった。
EORTC QLQ-C30、QLQ-HCC18を用いたQOL評価では、治療前のスコアは両群で同様であり、治療後のスコアは両群で低下した。EORTC QLQ-C30における活動性尺度、痛み、下痢のスコア、QLQ-HCC18における栄養、ボディーイメージのスコアは、Sorafenib群で有意に早く悪化していた(p<0.05)。
まとめ
Lenvatinib療法は、Sorafenib療法に対してOSにおける非劣性が認められ、切除不能肝細胞癌における初回化学療法として有用性が示された。
(レポート:愛知県がんセンター中央病院 薬物療法部 医長 成田 有季哉)
References
1) Crocenzi TS, et al.: 2016 Annual Meeting of American Society of Clinical Oncology®: abstr #4013
2) Cheng AL, et al.: J Clin Oncol. 31(32): 4067-4075, 2013[PubMed]
3) Johnson PJ, et al.: J Clin Oncol. 31(28): 3517-3524, 2013[PubMed]
4) Cainap C, et al.: J Clin Oncol. 33(2): 172-179, 2015[PubMed]
5) Zhu AX, et al.: J Clin Oncol. 33(6): 559-566, 2015[PubMed]
6) Ikeda K, et al.: J Gastroenterol. 52(4): 512-519, 2017[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師