Stage III結腸癌に対するOxaliplatin併用術後補助化学療法の投与期間(3 vs. 6ヵ月)に関する6つの第III相試験の前向き統合解析(IDEA collaboration)
Prospective pooled analysis of six phase III trials investigating duration of adjuvant Oxaliplatin-based therapy (3 vs. 6 months) for patients with stage III colon cancer: The IDEA (International Duration Evaluation of Adjuvant chemotherapy) collaboration.
Qian Shi, et al.
監修コメント

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
正直、本発表を1回聞いただけでは理解と解釈が難しい。本発表直後、ディスカッサントは、全体解析で非劣性を示せなかったnegative studyであることから、stage III結腸癌に対する術後補助化学療法は6ヵ月間のOxaliplatin併用療法がstandard of careであると述べた。至極真っ当な解釈である。しかし、その後のPost Plenary Sessionで、会場から「Not statistically significant, but clinically significant」、つまり本試験は統計学的にはnegativeだが臨床的には非劣性と考えてよいのではいか、との発言があり、拍手喝采の異様な盛り上がりを見せた。実際、全体での3年DFS割合の差は0.9%と小さく、サブグループ解析で低リスク例、CAPOX投与例では3ヵ月群の非劣性が示されたことから、ディスカッサントの通り一辺倒な解釈に納得がいかなかった聴衆が多かったのかもしれない。
FOLFOX投与例とCAPOX投与例で想定外に結果に差が出たことが、IDEAの解釈をより複雑なものにしている。統合元となったIDEA France試験1)、TOSCA試験2)、SCOT試験3)の3試験の結果も本学会期間中のOral Sessionで発表されたが、すべて異なる結果であった(図1-3)。CAPOX投与例が多く含まれた(67%)SCOT試験では、全体解析で3ヵ月群のDFSにおける非劣性が証明された(図3)。一方、FOLFOX投与例が90%を占めるIDEA France試験では、全体解析で有意に3ヵ月群が劣る結果であった(図1)。ESMO 2017では、本邦で実施したACHIEVE試験(CAPOXが75%)の結果が発表される予定である。ACHIEVE試験の結果を踏まえ、IDEAの結果をどのように本邦に適用するか、さらに議論されるだろう。
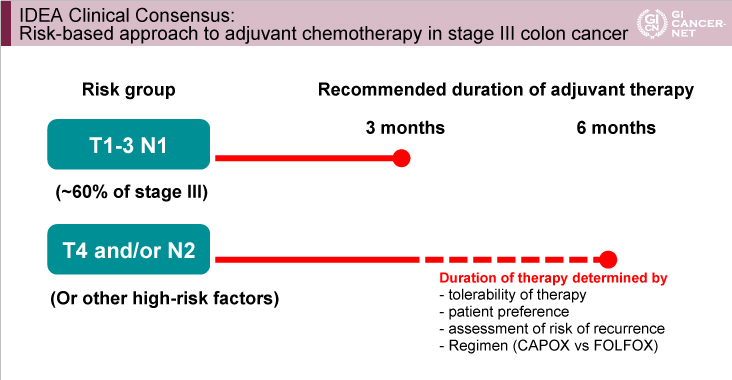
IDEAは、「全例で3ヵ月間投与に短縮しても良い」という結果ではない。しかし、3ヵ月経った時点で、治療レジメンや再発リスクによっては、今までよりも早めにOxaliplatinを中止する根拠になり得る結果であると考える。その際には、医師と患者とで、DFS低下の可能性と有害事象軽減とのtrade-offについて共有する必要がある。IDEAの発表を通して、非劣性試験の計画の難しさ、統計学的解釈と臨床的解釈の差について改めて考えさせられた。同時に、補助化学療法でのdecision makingについて見直す良いきっかけになった。Negative studyではあったが、明日からの日常臨床に活きる、Plenary Sessionに相応しい発表であった。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
特別コメント
横浜市立大学大学院医学研究科臨床統計学 教授 山中 竹春
ステージIII結腸癌におけるFOLFOX 6ヵ月 vs 5-FU/LVのDFS率の差、あるいはCapeOX 6ヵ月 vs Capecitabine単剤のDFS率の差は約5%である(MOSAIC試験、XELOXA試験)。今回の3ヵ月アームの効果がDFS率-5%を超えて6ヵ月アームよりも劣っていれば、3ヵ月アームは5-FU/LVやCapecitabine単剤を下回ってしまうことになる。そのため、3ヵ月アームの非劣性マージンはDFS率-5%よりも厳しい値に設定する必要があり、その観点からDFS率-2.5%に対応する非劣性マージンとしてハザード比1.12が設定された。1.12に対応して10,000例超という大規模なIDEA研究が計画された。
IDEAの主解析は、ハザード比の95%信頼区間(CI)上限が1.15だったため、P>0.05という結果になった。直観的に説明すると、1.15はDFS率-3.2%に相当し、許容限界として設定したDFS率-2.5%を超えて劣る可能性がある、だから統計的にはnegative studyという結論である。Post Plenary Sessionにおける初老の医師のコメント「2群のKM曲線は見た目くっついているじゃないか!」に会場は沸いたが、統計学上は見た目のKM曲線の差のみならず、95%CIまで考えるのでこのようなギャップが生じてしまう。
もっともIDEAの価値は、negative studyとなった原因をおおよそ特定できている点にあると私自身は考えている。3ヵ月アーム対6ヵ月アームの群間差(ハザード比)は、同じstage IIIであっても、リスク(T1-3N1 vs T4/N2)やレジメン(FOLFOX vs CapeOX)に応じて、サブグループによって異なる可能性がある、統計学の言葉では交互作用がある、これらが大規模臨床試験を実施して初めて分かったという点は重要だと思う。
IDEAは6試験の集合体なので、サブグループ解析においても「6試験の結果の再現性」を確認することができる。地域、人種、時期を超えた6つの試験が同様の傾向を示している場合は、サブグループ解析であっても結果の信頼性は高まると考えた方が自然である。さらに一つ一つのサブグループは数千例からなる。普段目にする数百例規模の臨床試験一本のサブグループ解析とは事情を異にする。
今後は日本発ACHIEVE試験の結果が発表されるので、それとIDEA全体の結果が整合するかどうかを確認しつつ、どのサブグループでどのレジメンの3ヵ月アームの臨床的価値があるのかの議論が深まっていくことを期待したい。
図1 IDEA France
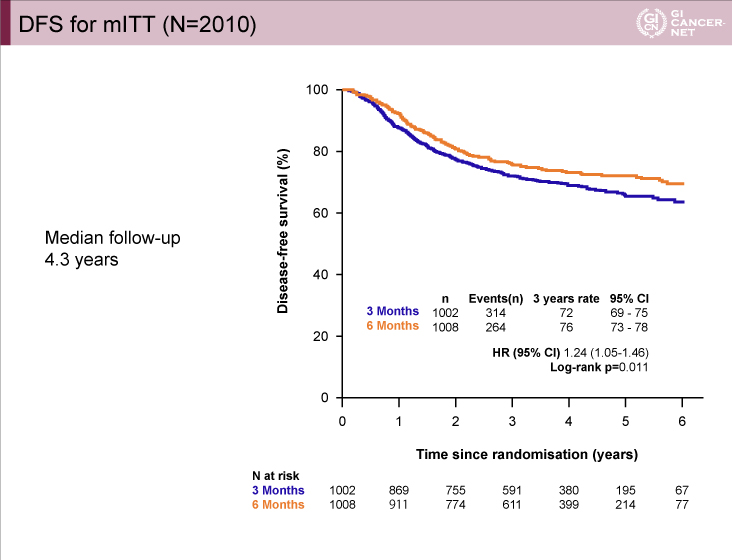
発表者の許可を得て掲載(approved by Thierry André)
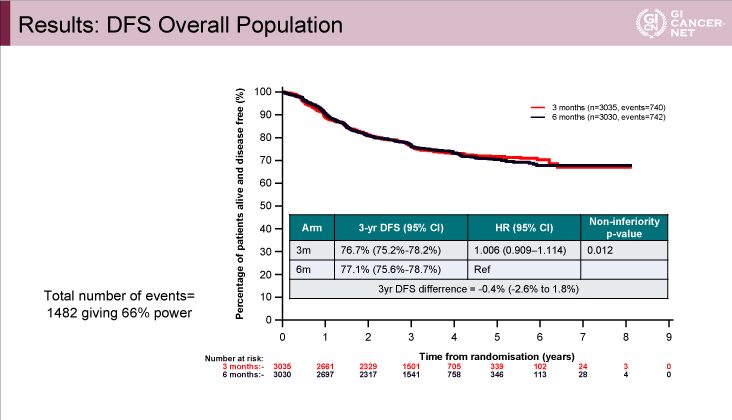
図2 TOSCA
発表者の許可を得て掲載(approved by Alberto Sobrero)
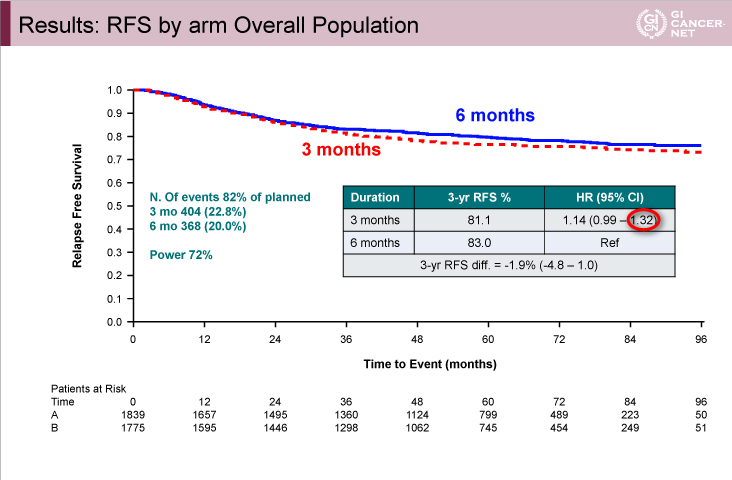
図3 SCOT
発表者の許可を得て掲載(approved by Timothy Iveson)
Oxaliplatinベース術後補助化学療法の投与期間を短縮できるか?
MOSAIC試験4)の結果、stage III結腸癌に対する術後補助化学療法として、Oxaliplatinをベースとしたレジメンの6ヵ月間投与が標準的治療として位置付けられてきた。一方でOxaliplatinの神経毒性は用量依存性であり、投与期間が長期に及ぶほど重篤化しやすく、FOLFOX 6ヵ月間投与によるgrade 3以上の神経毒性の発症率は12.5%であった5)。したがって、再発抑制効果を損なうことなく投与期間の短縮が可能となれば、癌患者にとっても、また医療資源の面においても利するところが大きいと考えられる。
IDEA(International Duration Evaluation of Adjuvant chemotherapy)collaborationは、結腸癌に対する術後補助化学療法としてのFOLFOX(5-FU/LV+Oxaliplatin)またはCAPOX(Capecitabine+Oxaliplatin)の投与期間について、3ヵ月間と6ヵ月間を比較した6つの前向き第III相無作為化試験[SCOT試験(英国、デンマーク、スペイン、オーストラリア、スウェーデン、ニュージーランド)、TOSCA試験(イタリア)、CALGB/SWOG C80702試験(米国、カナダ)、IDEA France試験(フランス)、ACHIEVE試験(日本)、HORG試験(ギリシャ)]を統合解析した研究である。
6ヵ月間投与に対する3ヵ月間投与の非劣性を検証
Stage III結腸癌に対するOxaliplatinベース術後補助化学療法の投与期間として6ヵ月間に対する3ヵ月間投与の非劣性を前向きに比較検討した第III相無作為比較試験を統合解析した(図4)。主要評価項目はDFS(disease-free survival)であり、6ヵ月群に対する3ヵ月群の相対リスク減少率を12%、非劣性検証マージンを1.12とし、片側α=0.025、検出力90%で、必要イベント数は3,390であった。なお、レジメンおよびT/N stageによるサブグループ解析が事前に計画されていた。
図4
発表者の許可を得て掲載(approved by Qian Shi)
Stage III結腸癌症例全体では3ヵ月間投与の非劣性は認められなかった
6つの臨床試験から12,834例のstage III結腸癌症例が抽出され、観察期間中央値は39ヵ月であった。各試験間における患者背景については、T4症例の割合(SCOT試験29%、ACHIEVE試験28%で高率)と、CAPOX投与例の割合(最小はC80702試験0%、最大はACHIEVE試験75%)において偏りが観察されたが(表1)、3ヵ月群と6ヵ月群、FOLFOX投与例とCAPOX投与例における患者背景はバランスがとれていた。
表1
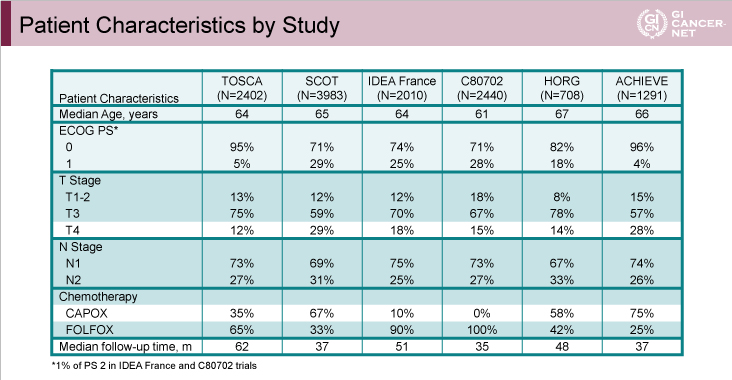
発表者の許可を得て掲載(approved by Qian Shi)
治療コンプライアンスは、3ヵ月群が6ヵ月群と比べてFOLFOX投与例(治療完遂率90% vs. 71%)、CAPOX投与例(同86% vs. 65%)のいずれにおいても良好であった。また、grade 2以上の神経毒性の発現頻度は、3ヵ月群が6ヵ月群と比べてFOLFOX投与例(17% vs. 48%, p<0.0001)、CAPOX投与例(15% vs. 45%, p<0.0001)のいずれにおいても有意に低率であった(表2)。
表2
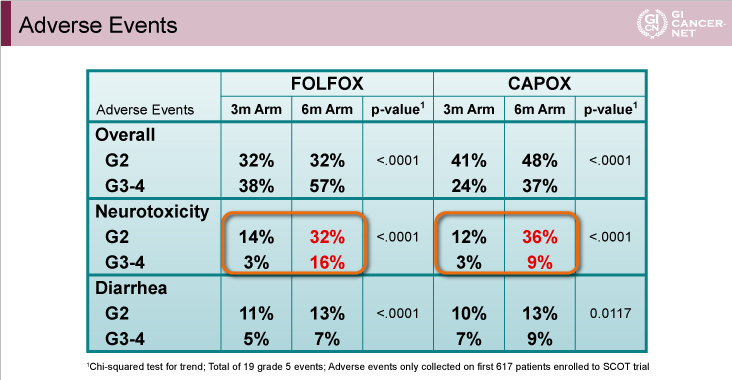
発表者の許可を得て掲載(approved by Qian Shi)
主要評価項目であるDFSは、3年DFS割合が3ヵ月群74.6%、6ヵ月群75.5%であり(HR=1.07, 95% CI: 1.00-1.15)(図5)、stage III結腸癌全体においては6ヵ月群に対する3ヵ月群の非劣性は認められなかった(図6)。
図5
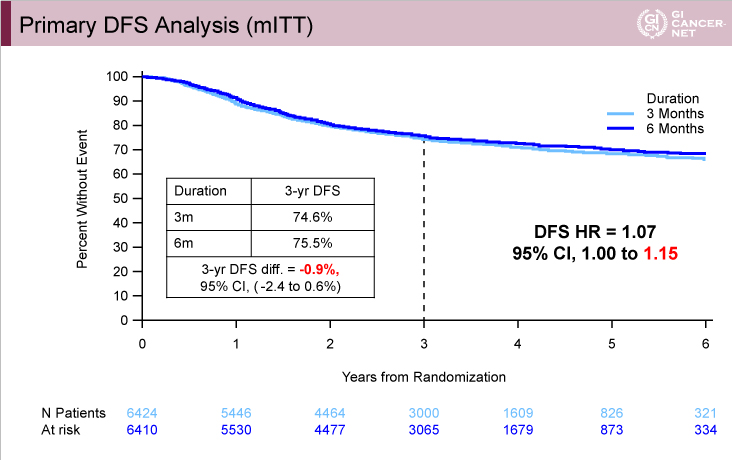
発表者の許可を得て掲載(approved by Qian Shi)
図6
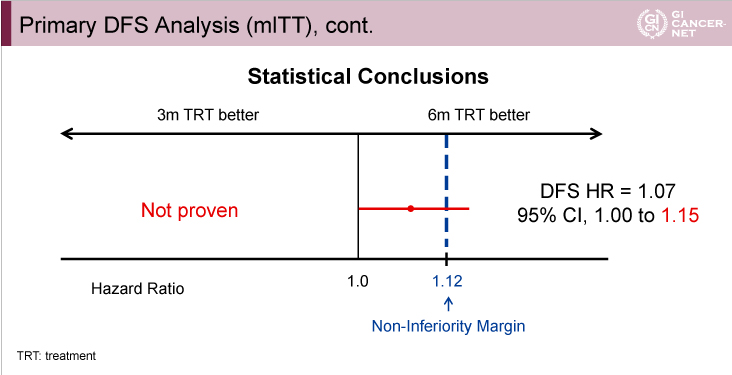
発表者の許可を得て掲載(approved by Qian Shi)
腫瘍の壁深達度とリンパ節転移から低リスク例(T1-3かつN1)と高リスク例(T4またはN2)に分けて検討したところ、高リスク例における3年DFS割合の両群の差は1.7%(3ヵ月群62.7%、6ヵ月群64.4%)であったのに対し、低リスク例では0.2%(3ヵ月群83.1%、6ヵ月群83.3%)であった(図7)。ハザード比は、高リスク例では3ヵ月群は6ヵ月群に比べて劣っていたが(HR=1.12, 95% CI: 1.03-1.23)、低リスク例では3ヵ月群の非劣性が認められた(HR=1.01, 95% CI: 0.90-1.12)(交互作用p=0.11)(図8)。
図7
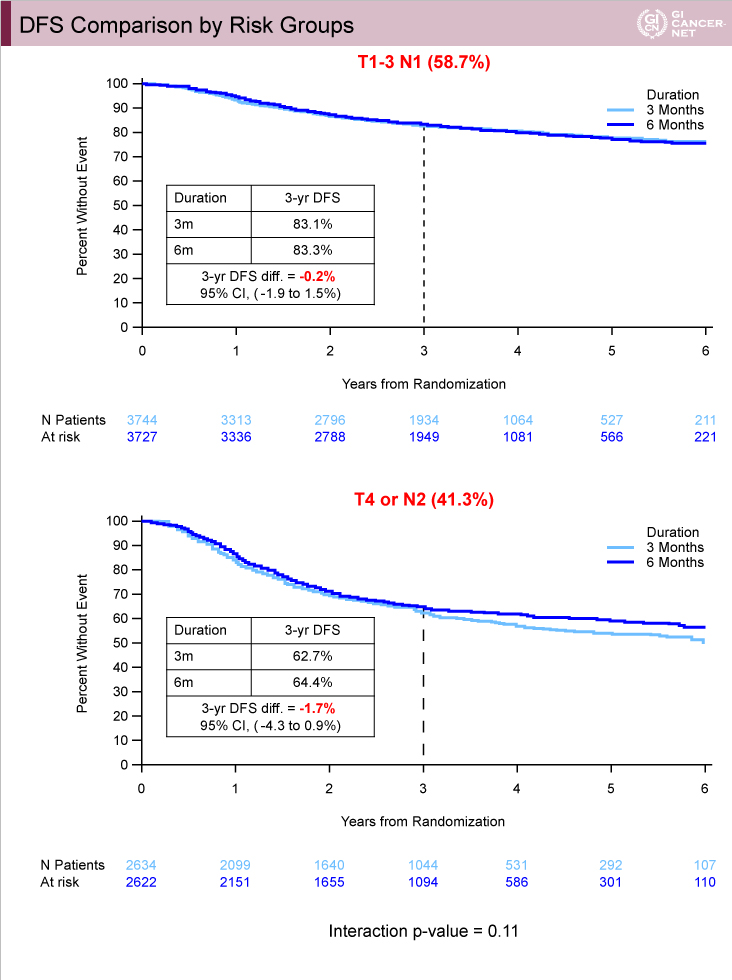
発表者の許可を得て掲載(approved by Qian Shi)
図8
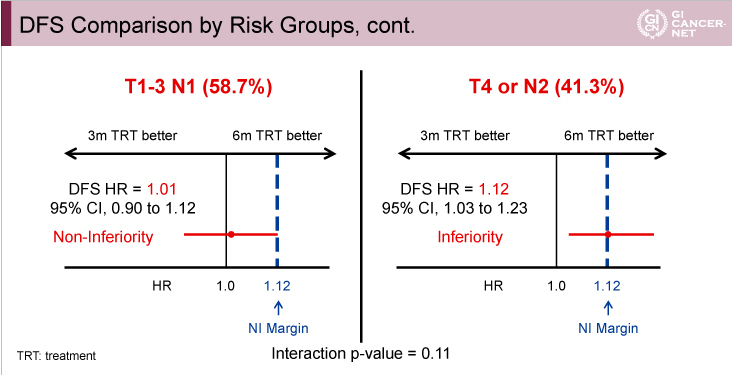
発表者の許可を得て掲載(approved by Qian Shi)
治療レジメン別の解析では、FOLFOX投与例における3年DFS割合の差は2.4%(3ヵ月群73.6%、6ヵ月群76.0%)であったのに対し、CAPOX投与例では1.1%(3ヵ月群75.9%、6ヵ月群74.8%)であった(図9)。ハザード比は、FOLFOX投与例では3ヵ月群は6ヵ月群と比べて劣っていたが(HR=1.16, 95% CI: 1.06-1.26)、CAPOX投与例では3ヵ月群の非劣性が認められた(HR=0.95、95% CI: 0.85-1.06)(交互作用p=0.0051)(図10)。
図9
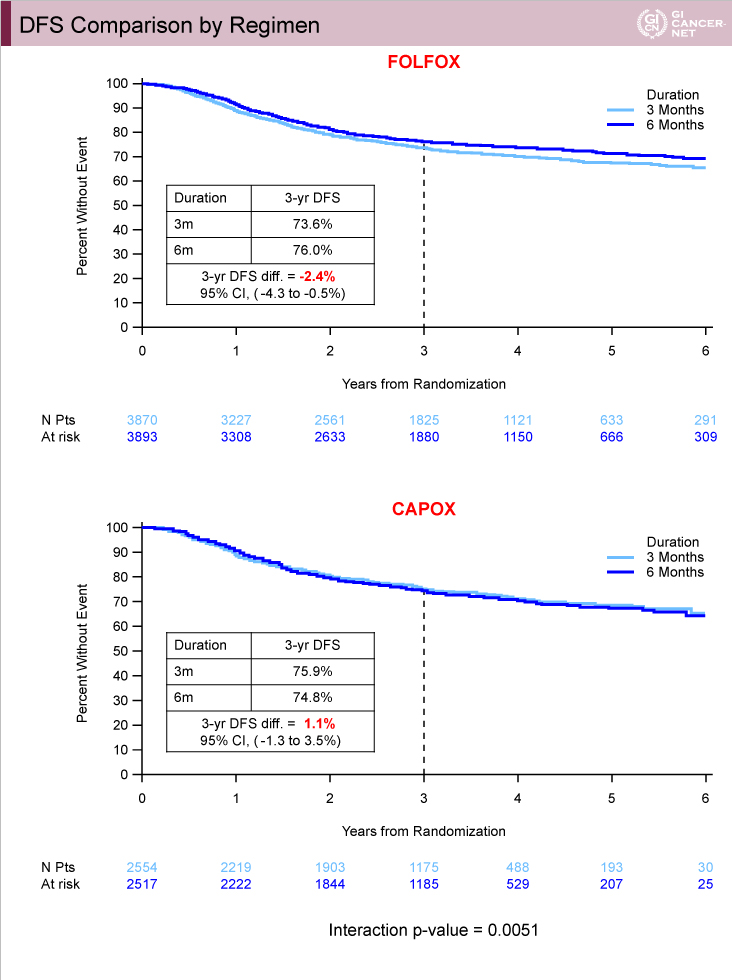
発表者の許可を得て掲載(approved by Qian Shi)
図10
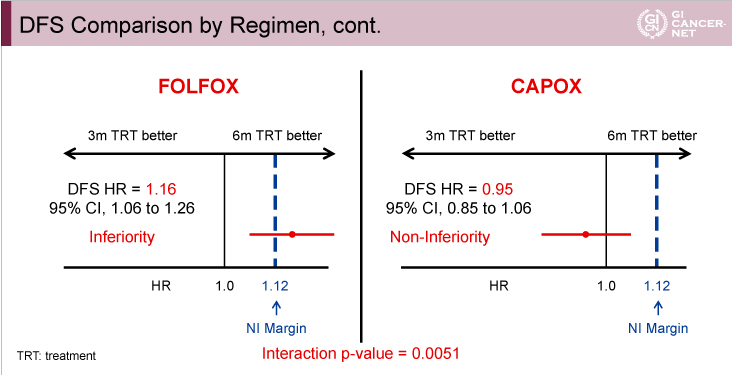
発表者の許可を得て掲載(approved by Qian Shi)
なお、リスク分類とレジメン別にDFSについて解析したところ、低リスク例におけるFOLFOX投与例では3ヵ月群の非劣性は認められなかったが(HR=1.10, 95% CI: 0.96 -1.26)、CAPOX投与例では3ヵ月群の非劣性が認められた(HR=0.85, 95% CI: 0.71-1.01)。一方、高リスク例におけるFOLFOX投与例では3ヵ月群は劣性であり(HR=1.20, 95% CI: 1.07-1.35)、CAPOX投与例では両群でほぼ同程度であったが非劣性は認められなかった(HR=1.02, 95% CI: 0.89-1.17)。
まとめ
Stage III結腸癌に対するOxaliplatinベースの術後補助化学療法の投与期間として、全体解析では6ヵ月間投与に対する3ヵ月間投与の非劣性は認められなかった。しかし、3ヵ月群では有意な神経毒性の減少を認め、再発リスクや治療レジメンによっては、6ヵ月群とDFSに差を認めなかった。ただ、本研究では3年DFS割合がOSの代替評価項目として使用されたが、本結果の頑健性を確認するためには長期OSのデータが必要である。
なお、統合された各臨床試験にはCAPOX投与例の割合に差異があり、治療レジメンと投与期間との相互作用が、今回の結果に影響を及ぼした可能性が高い。IDEAでは、治療レジメンは無作為化されていないため、FOLFOXとCAPOXとの差についてはselection biasの可能性が否定できない。治療期間はDFS低下の可能性と有害事象軽減とのtrade-offにより決定されるべきである。
図11
発表者の許可を得て掲載(approved by Qian Shi)
(レポート:九州大学大学院 消化器・総合外科 助教 中島 雄一郎)
References
1) André T, et al.: 2017 Annual Meeting of American Society of Clinical Oncology®: abstr #3500
2) Sobrero A, et al.: 2017 Annual Meeting of American Society of Clinical Oncology®: abstr #3501
3) Iveson T, et al.: 2017 Annual Meeting of American Society of Clinical Oncology®: abstr #3502
4) André T, et al.: N Engl J Med. 350(23): 2343-2351, 2004[PubMed][論文紹介]
5) André T, et al.: J Clin Oncol. 27(19): 3109-3116, 2009[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
レポーター (50音順)
新井 裕之先生
聖マリアンナ医科大学
臨床腫瘍学 診療助手
川上 尚人先生
近畿大学医学部
内科学腫瘍内科部門 医学部講師
中島 雄一郎先生
九州大学大学院
消化器・総合外科 助教
成田 有季哉先生
愛知県がんセンター中央病院
薬物療法部 医長
宮本 敬大先生
国立がん研究センター中央病院
消化管内科 がん専門修練医
山田 武史先生
筑波大学附属病院
消化器内科 病院講師