Bevacizumabを含む化学療法に不応後のKRAS野生型切除不能進行・再発大腸癌に対するIrinotecan+Cetuximab(IC)療法とIrinotecan+Cetuximab+Ramucirumab(mICR)療法を比較した無作為化第II相試験(E7208試験)
A randomized phase II study of irinotecan and cetuximab (IC) with or without the anti-angiogenic antibody, ramucirumab (IMC-1121B) (mICR), in advanced, K-ras wild-type colorectal cancer following progression on bevacizumab-containing chemotherapy (E7208)
Howard S. Hochster, et al.
監修コメント

加藤 健先生
国立がん研究センター中央病院 消化管内科 医長
大腸癌に対する主な分子標的治療薬である血管新生阻害剤と抗EGFR抗体薬は、同時に用いず、それぞれ化学療法と併用する(抗EGFR抗体薬はたまに単独でも用いる)ことが基本的な使い方である。これは、CAIRO2試験などにおいて、これらの薬剤の併用により、下痢などの毒性が増すことで逆効果となり、かえって有効性が劣ってしまうことが報告されているからである1,2)。今回は、BevacizumabをRamucirumabに置き換えることで、再び「Building a Block Strategy」が、大腸癌でまだ可能性があるのかをみた試験である。
結果を述べる前に注意すべき点がいくつかある。研究者は二次化学療法の標準治療としてIrinotecan+Cetuximabを用いているが、一次化学療法がOxaliplatin+Bevacizumabベースの場合、通常は、5-FU+Leucovorin+Irinotecan(FOLFIRI)療法+血管新生阻害剤を用いるべきLineである。また対象はKRAS野生型とされているが、抗EGFR抗体薬の効果がない、いわゆるRASのマイナー変異症例も含まれている。そもそもRAS野生型の左側原発大腸癌に対しては初回治療例として抗EGFR抗体薬が最近では多く用いられており、現在のPracticeと若干異なる設定で行われているということである。
結果は、片側α=15%の設定のためp=0.069でも設定上はポジティブであるが、全生存(OS)期間においてはほぼ差が見出せていない。Irinotecan、Cetuximab、Ramucirumabの3剤併用療法群において有害事象が多く発生したため、プロトコール改訂を行い、各薬剤の投与量を1レベルずつダウンしており、結果として抗腫瘍効果もダウンしたという印象である。無増悪生存(PFS)期間の比がハザード比(HR)=0.65と比較的良い数字であること、かつ統計学的にはメットしているため、研究者は第III相試験を実施して有効性を確かめたいという前向きな結論であったが、確実に毒性は強くなるわりに、OS期間の改善効果は認められず、かつ臨床的にこのLineで用いられる可能性が今後低いため、ディスカッサントもそれに対しては否定的なコメントであった。10年ぶりに登場した「Building a Block Strategy」は、脚光を浴びることのないまま消えていくものと思われる。
(コメント・監修:国立がん研究センター中央病院 消化管内科 医長 加藤 健)
切除不能進行・再発大腸癌に対する抗VEGF(R)抗体薬+抗EGFR抗体薬の併用療法
切除不能進行・再発大腸癌に対する初回治療の選択肢として、Oxaliplatinベースの化学療法とBevacizumabの併用療法が日常診療で広く行われている。また、Bevacizumabを含む一次化学療法に不応・不耐となった場合、Bevacizumab(Beyond Bevacizumab Progression)、Ramucirumab、Afliberceptなどの血管新生阻害にかかわる抗体薬を化学療法と併用することで、化学療法単独と比較して有意に生存期間を延長することが分かっている。
Ramucirumabは、VEGFR-2を標的としたモノクローナル抗体である。腫瘍細胞の増生や転移には新たな血管新生が必須である。腫瘍細胞や間質細胞から分泌される血管内皮増殖因子(VEGF)と血管やリンパ管の内皮細胞に発現するVEGF受容体(VEGFR)との相互作用は、腫瘍組織における血管新生に大きな役割を果たしており、これらの蛋白発現は重要な治療標的になっている。
抗VEGF抗体薬(Bevacizumab)と抗EGFR抗体薬の併用療法は、一次化学療法においては有害事象の発現頻度が高く、全生存(OS)期間の延長に寄与しないことが過去に報告されている1,2)。標準治療に不応となった治療Lineを対象としたBOND-2試験では、Irinotecan+Cetuximab+Bevacizumab療法の奏効率(ORR)が37%、無増悪期間(TTP)が7.3ヵ月であり、KRAS変異の有無にかかわらず良好な成績であった3)。しかし、これらの抗体薬の併用療法の有用性は第III相試験レベルのエビデンスでは証明されておらず、日常診療で使用することは推奨されていない。
E7208試験は、Bevacizumabを含む初回化学療法に不応・不耐となったKRAS野生型の二次化学療法を対象に、Irinotecan+Cetuximab(IC)療法群とIrinotecan+Cetuximab+Ramucirumab(ICR)療法群の有用性と安全性を比較した無作為化第II相試験である。
二次化学療法であるIC療法に対するRamucirumabの上乗せ効果と安全性を評価
E7208試験は、IC療法群[A群:Irinotecan(180mg/m2、day 1)+Cetuximab(500mg/m2、day 1)、2週毎]とICR療法群[B群:Irinotecan(180mg/m2、day 1)+Cetuximab(500mg/m2、day 1)+Ramucirumab(8mg/kg、day 1)、2週毎]に1:1で無作為に割り付ける試験デザインであった。しかし、ICR療法群で好中球数減少、口内炎、下痢などの有害事象が強く発現したため、ICR療法の各薬剤を1レベルずつ減量したmICR療法(Irinotecan:180→150mg/m2、Cetuximab:500→400mg/m2、Ramucirumab:8→6mg/kg)群(C群)を新たに設定し、IC療法群(A群)とmICR療法群(C群)を比較する試験デザインにプロトコール改訂された。層別因子はECOG PS(performance status)0 vs. 1/2、前治療でのOxaliplatin投与中断の有無、前治療でのBevacizumab最終投与からの期間(6ヵ月未満 vs. 6ヵ月以上)であった。
主たる適格規準は、測定可能病変を有する、結腸もしくは直腸の腺癌Stage IV、KRAS野生型、前治療としてOxaliplatinベースの化学療法とBevacizumabの併用療法を施行された二次化学療法の症例、PS 0/1、臓器機能が保たれている、28日以内に主要な手術を受けていない、PT-INR<1.6(Warfarinによる抗凝固療法を施行していない場合に限る)、血圧が安定している(内服薬で<160/90mmHg)、6ヵ月以内に動脈血栓塞栓症の既往がない、Bevacizumabの最終投与日から少なくとも28日以上経過していること、であった。
当初はPFS期間中央値をIC療法群4.5ヵ月、ICR療法群7.65ヵ月として、検出力90%、片側α=0.1と設定していた。mICR療法のプロトコール改訂後は、100例を新たに登録し、IC療法群(A群)とmICR療法群(C群)に1:1で割り付ける計画となった。両群各48例登録した場合の検出力を90→85%、片側α=0.1→0.15(層別log-rank検定)にそれぞれ変更した場合、mICR療法群のPFS期間の延長を証明するためには、イベント数67、HR=0.59、PFS中央値はIC療法群4.5ヵ月、mICR療法群7.65ヵ月が必要となった。
最終的に、IC療法群50例、mICR療法群47例が無作為に割り付けられた。IC療法群とmICR療法群における患者背景は、年齢中央値(58歳 vs. 60歳)、PS 0/1(50%/50% vs. 53%/47%)、男性(58% vs. 72%)、結腸癌/直腸癌(65%/35% vs. 68%/32%)、肝転移(71% vs. 72%)、肺転移(42% vs. 51%)、腹膜播種(17% vs. 11%)、前治療でのOxaliplatin中断割合(76% vs. 77%)、前治療でのBevacizumab最終投与から治療開始までの期間が6ヵ月未満(86% vs. 83%)であった。
治療サイクル数の中央値(範囲)は8(1-36) vs. 11(1-56)、治療サイクル数の平均値は9.8 vs. 12.9であった。プロトコール治療の中止理由としては、病勢進行(PD)(61% vs. 61%)、有害事象(23% vs. 13%)、治療中断もしくは変更(12% vs. 13%)、死亡(2% vs. 5%)であった。
全例が前治療としてフッ化ピリミジン系薬剤+Oxaliplatin+Bevacizumab療法を受けていた。登録時の治療レジメンは、5-FU/LV+Oxaliplatin(FOLFOX)+Bevacizumab療法が約29%、フッ化ピリミジン系薬剤+Bevacizumab療法が約28%、Bevacizumab単剤が約14%、無治療が約28%であった。両群における登録時の各薬剤使用割合は、Oxaliplatinが30% vs. 27%、フッ化ピリミジン系薬剤が52% vs. 57%、Bevacizumabが72% vs. 60%、無治療22% vs. 30%であった。
mICR療法でPFS期間の延長を示したが、ORRとOS期間では差が認められなかった
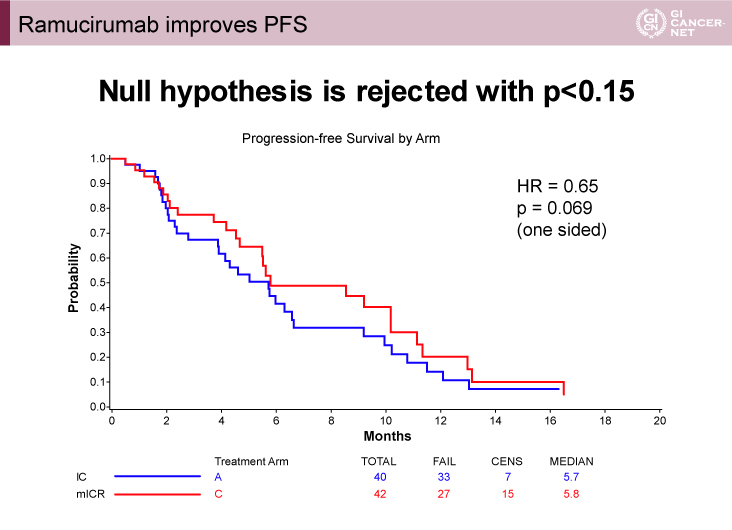
主要評価項目であるPFS期間の中央値は、IC療法群5.7ヵ月、mICR療法群5.8ヵ月(HR=0.65、片側検定p=0.069)であった。本試験の統計学的な設定では、mICR療法群で有意なPFSの延長が認められた。(p<0.15)(図1)。
図1 Progression-free survival(発表者の許可を得て掲載)
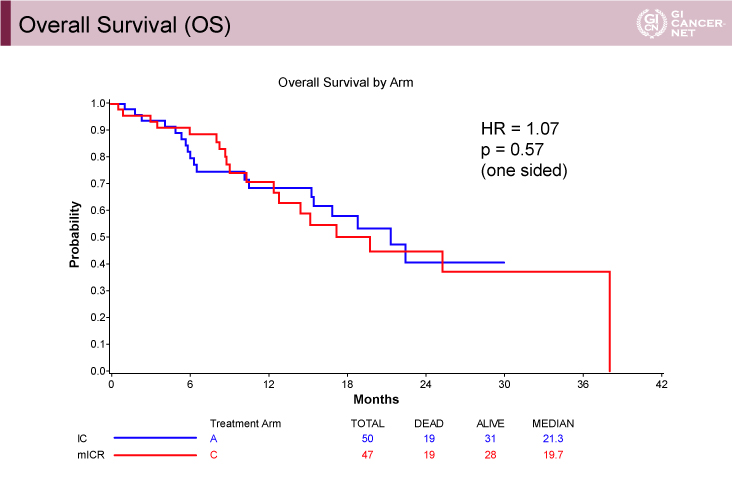
副次評価項目であるOS期間の中央値(MST)は、IC療法群21.3ヵ月、mICR療法群19.7ヵ月(HR=1.07、片側検定p=0.57)で、両群で有意な差は認められなかった(図2)。また、ORRに関しても、IC療法群22%(CR 2%、PR 20%)、mICR療法群28%(CR 0%、PR 28%)と両群で有意な差は認められなかった(p=0.48)。奏効期間(DR)の中央値は、IC療法群5.5ヵ月、mICR療法群8.1ヵ月であった。
図2 Overall survival(発表者の許可を得て掲載)
層別因子における予後解析では、前治療でOxaliplatinを中断した群が、中断しなかった群と比較して有意にPFS期間の延長が認められた(中央値:6.6ヵ月 vs. 4.2ヵ月、HR=0.48、p=0.0049)。また、前治療でのBevacizumabの最終投与から治療開始までの期間が6ヵ月以上であった群は、6ヵ月未満の群と比較してPFS期間(中央値:10.2ヵ月 vs. 5.5ヵ月、HR=0.26、p=0.0049)とOS期間(MST:38.0ヵ月 vs 15.4ヵ月、HR=0.14、p=0.0073)で有意な延長が認められた。
mICR療法では、Grade 3以上の口内炎、下痢の発現頻度が高かった
IC療法群とmICR療法群におけるGrade 3/4の有害事象は、それぞれ47%と56%で認められ、好中球数減少(9% vs. 10%)、リンパ球数減少(3% vs. 10%)、貧血(1% vs. 6%)、低マグネシウム血症(6% vs. 0%)、蛋白尿(0% vs. 4%)、高血圧(0% vs. 4%)、食欲不振(0% vs. 2%)、悪心・嘔吐(1% vs. 2%)、口内炎(1% vs. 6%)、ざ瘡様皮疹(11% vs. 4%)、下痢(10% vs. 15%)であった。mICR療法群では口内炎、下痢の発現頻度が高い傾向が認められた。
まとめ
切除不能進行・再発大腸癌の二次化学療法におけるICR療法は、有害事象が強く発現することから薬剤の減量を必要とした。mICR療法は、IC療法と比較してPFS期間の延長効果を示したが、ORR、OS期間では有意な差が認められなかった。
(レポート:埼玉県立がんセンター 消化器内科 高橋 直樹)
References
1) Hecht JR, et al.: J Clin Oncol. 27(5): 672-680, 2009[PubMed]
2) Tol J, et al.: N Engl J Med. 360(6): 563-572, 2009[PubMed]
3) Saltz LB, et al.: J Clin Oncol. 25(29): 4557-4561, 2007[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科