進行膵神経内分泌腫瘍(pNET)に対するTemozolomide療法とTemozolomide+Capecitabine療法の無作為化第II相比較試験(E2211試験)
A randomized phase II study of temozolomide or temozolomide and capecitabine in patients with advanced pancreatic neuroendocrine tumors: a trial of the ECOG-ACRIN Cancer Research Group (E2211)
Pamela L. Kunz, et al.
監修コメント

上野 誠先生
神奈川県立がんセンター
消化器内科 医長
低~中Gradeの膵神経内分泌腫瘍におけるTemozolomideとCapecitabineの併用療法が報告された。両者は、MGMT(O6-methyl guanine methyl transferase)欠損の機序により相乗的な効果が期待された。膵神経内分泌腫瘍は予後が長いことから、無増悪生存(PFS)期間を主要評価項目として比較試験が行われることが多く、本試験も同様である。第II相試験ではあるものの、PFS期間、全生存(OS)期間ともに有意な延長を認め、TemozolomideとCapecitabineの併用療法の有用性が示された。
本来は第III相試験による比較やStreptozocin併用療法との比較も注目されるが、稀少癌であることから現実には難しい。
Temozolomideは海外のガイドラインにも記載され、膵神経内分泌腫瘍の重要な治療選択肢であるが、本邦での保険承認はない。いわゆるドラッグラグの典型であり、関連学会からの公知申請も検討されている。本試験の結果が、国内開発、保険承認に向けて、追い風となることを期待したい。膵神経内分泌腫瘍については、本治療だけでなく、現在、国内でペプチド受容体放射性核種療法(PRRT)の治験も進行中である。稀少癌として新規治療開発の難しい領域であるが、早期に治療選択肢が増えることを望む。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
TemozolomideとCapecitabineの併用投与による相乗効果を期待
Temozolomideはアルキル化剤の1つであり、以前より神経内分泌腫瘍に対する有効性が報告されていた。Temozolomideの治療効果予測因子としてMGMT(O6-methyl guanine methyl transferase)欠損が挙げられるが、CapecitabineはMGMT欠損を起こすため、TemozolomideとCapecitabineの併用投与は相乗効果が期待できると考えられてきた。過去の後ろ向き研究もしくは小規模前向き試験において、この併用療法は36~70%と高い奏効率(ORR)が報告されており、Temozolomide単独投与とTemozolomideとCapecitabineの併用投与を比較する無作為化試験が行われた。
Temozolomide療法とTemozolomide+Capecitabine療法を比較した第II相試験
E2211試験は、切除不能または遠隔転移を有する、過去12ヵ月間に進行が確認されたWHO基準PS(performance status) Grade 1/2の膵神経内分泌腫瘍患者を対象とし、Temozolomide療法群(200mg/m2、day 1~5、28日毎、13サイクルまで)と、Temozolomide+Capecitabine療法群[(Temozolomide 200mg/m2、day 10–14)+Capecitabine 750mg/m2、1日2回、day 1–14、28日毎、13サイクルまで)]に1:1で割り付けられた。Everolimus、Sunitinib投与とOctreotideの同時併用は許容したが、Temozolomide、Capecitabine、Dacarbazine(DTIC)、Fluorouracil(5-FU)の投与歴がある患者は除外された。
主要評価項目は、無増悪生存(PFS)期間、副次評価項目は、奏効率(ORR)、全生存(OS)期間、安全性とされた。Temozolomide療法群とTemozolomide+Capecitabine療法群における各PFSの中央値を9ヵ月、14ヵ月と仮定し[ハザード比(HR)=0.64に相当]、両側α=0.20、検出力81%として、必要症例数は144例と算出された。PFSのイベントが80例観察された時点で中間解析が予定され、今回はその結果の発表である。
Temozolomide+Capecitabine療法が有意にPFSを延長
2013年8月から2016年3月までに144例が登録され、72例ずつ割り付けられた。患者背景はTemozolomide療法群/Temozolomide+Capecitabine療法群においてそれぞれ、年齢中央値59.5歳/62.5歳、WHO基準PS Grade 1 45.1%/68.1%に有意差を認めた(p=0.013)。層別因子であったEverolimusまたはSunitinibの投与歴、ならびにSomatostatinの同時併用の有無には差を認めなかった。
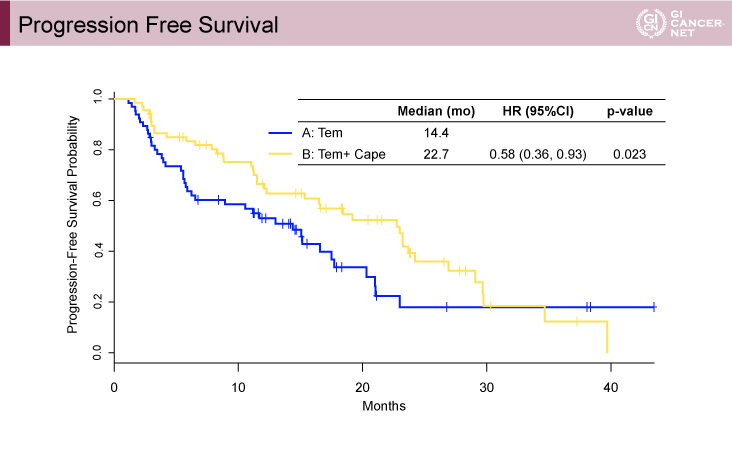
観察期間中央値29ヵ月において、主要評価項目であるPFSの中央値はTemozolomide療法群14.4ヵ月、Temozolomide+Capecitabine療法群22.7ヵ月、HR=0.58(95% CI: 0.36–0.93、p=0.023)であった(図)。前述したように組織Gradeに群間差を認めていたが、PS Grade 1または2においてPFS期間に有意差は認めず(p=0.41)、感度解析でもPFS期間のHRは0.61(p=0.042)と大きな違いは認めなかった。
図 Progression free survival(発表者の許可を得て掲載)
副次評価項目であるOSの中央値(MST)は、Temozolomide療法群38.0ヵ月、Temozolomide+Capecitabine療法群MST未到達、HR=0.41(95% CI: 0.21–0.82、p=0.012)であった。Temozolomide療法群とTemozolomide+Capecitabine療法群におけるORRはそれぞれ27.8% vs. 33.3%(p=0.47)、病勢制御率(DCR)は68.1% vs. 81.9%であった。
安全性解析対象のTemozolomide療法群68例とTemozolomide+Capecitabine療法群71例におけるGrade 3/4の有害事象は、好中球数減少4% vs. 13%、悪心0% vs. 8%、嘔吐0% vs. 8%、下痢0% vs. 8%、疲労1% vs. 8%であり、Grade 3/4の有害事象発現率はTemozolomide+Capecitabine療法群で有意に高かったが(22% vs. 44%、p=0.007)、いずれの治療群も忍容性は良好と判断された。
まとめ
TemozolomideとCapecitabineの併用療法は、低~中Gradeの進行膵神経内分泌腫瘍に対して有望な治療レジメンである。
Temozolomide+Capecitabine療法群はTemozolomide療法群に比べ、PFS期間、OS期間ともに延長することが示された。Temozolomide+Capecitabine療法群のORRは従来の標準治療に比べ高率で、これまでに行われた前向き試験中、最長のPFS期間を示したため、非常に有望な治療レジメンであると考えられた。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科