Stage IIIの根治切除胃癌に対する術後補助化学療法としてのS-1+Docetaxel療法とS-1療法の無作為化比較第III相試験[JACCRO GC-07(START-2)試験]
A randomized phase III study comparing S-1 plus docetaxel with S-1 alone as a postoperative adjuvant chemotherapy for curatively resected stage III gastric cancer (JACCRO GC-07 trial)
Yasuhiro Kodera, et al.
監修コメント

谷口 浩也先生
愛知県がんセンター中央病院 薬物療法部 医長
周術期補助化学療法の開発は予後不良な胃癌の治療成績を向上させる最も重要なアプローチである。今回、本邦における良質な第III相試験により、従来の標準治療であるS-1療法と比較してDocetaxel+S-1(DS)療法の優越性が証明されたことから、DS療法が、pStage III胃癌に対する術後補助化学療法(adjuvant chemotherapy)における本邦での今後の標準治療となる。
無再発生存(RFS)のサブグループ解析でもpStage(IIIA/IIIB/IIIC)や組織型、年齢などとの交互作用もなく、広く実地臨床で有効性が期待できることが示唆される。Docetaxelによる脱毛は認められるものの、発熱性好中球減少症の発現頻度も5%程度であることから、有害事象も概ね許容範囲内である。消化器毒性がS-1療法群と大きく変わらなかった背景には、DS療法群においても1コース目はS-1単独投与とするなどキードラッグであるS-1の用量強度を保つ細かい工夫があった。
S-1療法群の治療成績が従来の本邦からの報告よりやや悪いことは気になるが、欧州での第III相試験でも周術期におけるDocetaxel[Docetaxel+Oxaliplatin+5-FU/LV(FLOT)療法]の有効性が再現されていることから、本試験結果の信頼性は揺るがないと考える。本試験の対象となっていないStage IIや術前補助化学療法(neoadjuvant chemotherapy)への展開など、本試験結果を受け、治療開発がますます加速するだろう。司会のChiorean先生が、大きく開いた2本のRFS曲線を見て驚きのあまりため息を漏らしたのは印象的であった。2018年の消化管癌領域に関する発表では、一番実地臨床へのインパクトが大きい発表であった。
(コメント・監修:愛知県がんセンター中央病院 薬物療法部 医長 谷口 浩也)
現在の標準治療は、pStage IIIの胃癌に対する術後補助化学療法として効果不十分
本邦では、S-1療法1年あるいはXELOX療法6ヵ月というのが、根治切除を行ったpStage II/III胃癌に対する術後補助化学療法(adjuvant chemotherapy)の標準治療となっている1)。しかし、pStage IIIにおいては、手術単独群に対するStage IIIA/IIIBの全生存(OS)期間のハザード比(HR)が、S-1療法で0.67 vs. 0.86、XELOX療法で0.75 vs. 0.672-5)と、いずれも効果が不十分であり、さらなる治療成績の向上が望まれている。
日韓共同で行われた切除不能進行・再発胃癌に対するDocetaxel+S-1(DS)療法とS-1療法を比較する第III相試験(JACCRO GC-03試験/START trial)では、DS療法とS-1療法において、OS期間中央値12.5ヵ月 vs. 10.8ヵ月(HR=0.84、p=0.032)、無増悪生存(PFS)期間中央値5.3ヵ月 vs. 4.2ヵ月(HR=0.77、p=0.001)で、いずれもDS療法が有意に良好であった6)。この試験結果より、DS療法が新たな術後補助化学療法の候補と期待された。
S-1療法に対するDS療法の優越性を検証
本試験の対象は根治切除(胃切除+D2郭清)を行ったpStage III胃腺癌患者で、S-1療法群(S-1 80mg/m2、day1-28、6週毎)とDS療法群[1コース目および8コース目以降術後1年後までは、S-1 80mg/m2、day 1-28、3週毎および6週毎、2~7コース目は、(Docetaxel 40mg/m2、day 1)+(S-1 80mg/m2、day 1-14)、3週毎]に無作為に割り付けられた。層別因子は施設、pStage(IIIA vs. IIIB vs. IIIC)、組織型(分化型 vs. 未分化型)であった。
主要評価項目は3年無再発生存(RFS)、副次評価項目は3年OS期間、5年RFS、5年OS期間、治療成功期間(TTF)、有害事象とされた。S-1療法群の3年RFSを62%とし、DS療法群のそれが7%上回るかどうか(HR=0.78)を検出する優越性試験デザインとし、両側検定α=5%、検出力80%、必要解析対象数は1群550例、両群計1,100例とされた。
術後補助化学療法において、DS療法の優越性が示された
2017年4月、実施計画書に基づいて第2回の中間解析が行われた(登録患者915例、イベント数216)。主要評価項目である3年RFSは、S-1療法群49.5% vs. DS療法群65.9%(層別log-rank検定、HR=0.632、99.99% CI: 0.400-0.998、p=0.007)と、DS療法群で有意に良好であったことから(図1)、2017年9月、効果安全性評価委員会において「有効中止」の勧告がなされた。
図1 3-year Relapse-free Survival(発表者の許可を得て掲載)
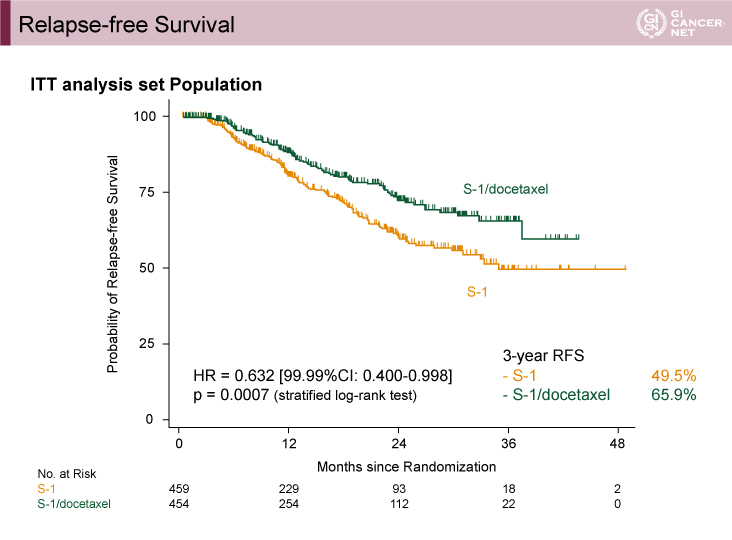
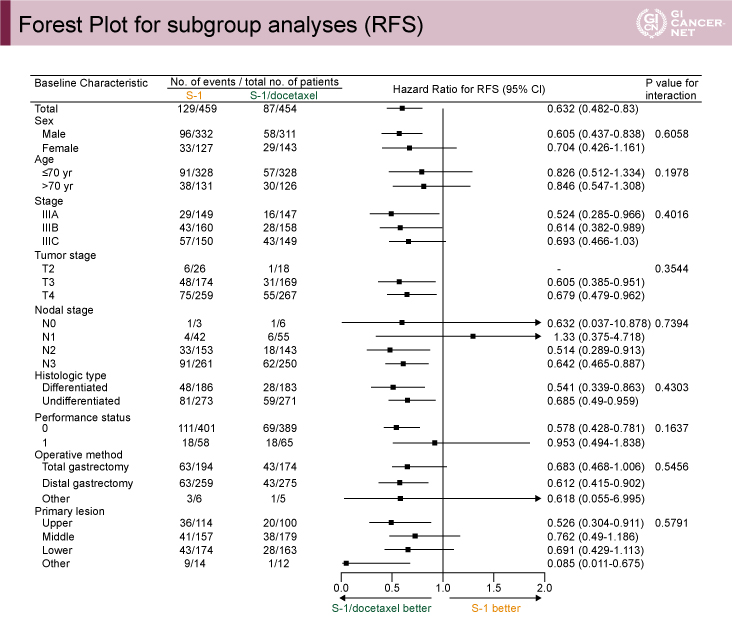
両群の患者背景には明らかな差が認められなかった。サブグループ解析では、年齢、性別、pStage(IIIA/IIIB/IIIC)など特定の集団との明らかな交互作用は認められなかった(図2)。初回再発部位は、リンパ節、腹膜、血行性転移のいずれにおいてもDS療法群で少ない傾向であった。
図2 Forest Plot for subgroup analyses (RFS)(発表者の許可を得て掲載)
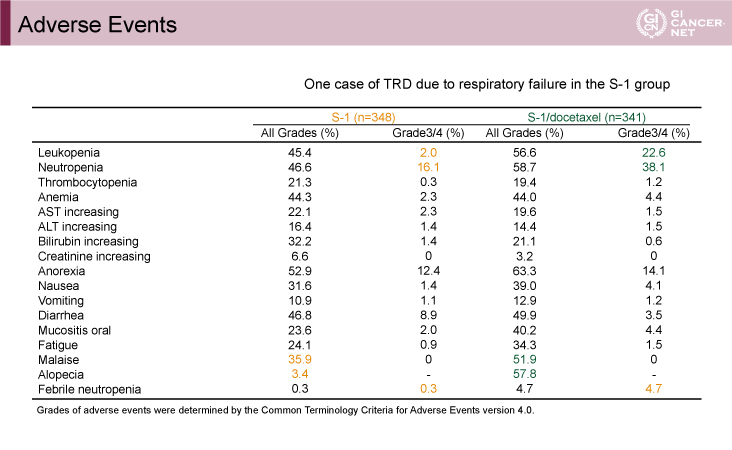
S-1療法群とDS療法群におけるGrade 3/4の有害事象では、白血球減少(2.0% vs. 22.6%)、好中球減少(16.1% vs. 38.1%)、発熱性好中球減少症(0.3% vs. 4.7%)が、全Gradeの有害事象では、倦怠感(35.9% vs. 51.9%)、脱毛症(3.4% vs. 57.8%)が、DS療法群で多く認められたものの、それ以外はほぼ同程度であった(表1)。
表1 Adverse Events(発表者の許可を得て掲載)
まとめ
根治切除(胃切除+D2郭清)を行ったpStage III胃癌に対して、DS療法は新たな術後補助療法の標準治療として推奨される。
(レポート:国立がん研究センター中央病院 臨床研究支援部門 佐藤 雄哉)
References
1) 日本胃癌学会:胃癌治療ガイドライン(第5版),2018
2) Sakuramoto S, et al.: N Engl J Med. 357(18): 1810-1820, 2007[PubMed]
3) Sasako M, et al.: J Clin Oncol. 29(33): 4387-4393, 2011[PubMed]
4) Bang YJ, et al.: Lancet. 379(9813): 315-321, 2012[PubMed]
5) Noh SH, et al.: Lancet Oncol. 15(12): 1389-1396, 2014[PubMed]
6) Koizumi W, et al.: J Cancer Res Clin Oncol. 140(2): 319-328, 2014[PubMed]

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科