切除後膵癌に対する術後補助化学療法におけるmodified FOLFIRINOX(mFFX)療法とGemcitabine療法を比較した多施設共同無作為化第III相試験(PRODIGE 24/CCTG PA.6試験)
PRODIGE 24/CCTG PA.6, an Unicancer GI trial: a multicenter international randomized phase III trial of adjuvant mFOLFIRINOX versus gemcitabine (gem) in patients with resected pancreatic ductal adenocarcinomas
Thierry Conroy, et al.
監修コメント

上野 誠先生
神奈川県立がんセンター
消化器内科 医長
膵癌術後補助化学療法(adjuvant chemotherapy)として、欧米における新たな標準治療が誕生した。従来、Gemcitabine療法が標準治療であり、近年、Gemcitabine+Capecitabine療法が欧米において標準治療と位置づけられていた。周知のように、FOLFIRINOX療法[Fluorouracil(5-FU)+Leucovorin+Irinotecan+Oxaliplatin]は、遠隔転移を有する膵癌での標準治療として位置づけられており、術後補助化学療法としてもその有用性が期待された。膵癌術後は、毒性の増強が予想され、今回の試験ではbolus 5-FUを省略したレジメンで開始された。さらに、下痢の増強によりIrinotecanが150mg/m2に減量された。本試験では、無病生存(DFS)期間、全生存(OS)期間ともに有意な延長が示され、欧米の標準治療として確立したと考えられる。一方で、Gemcitabine+nab-Paclitaxel療法の術後補助化学療法の第III相試験も今後、結果が注目される。
本邦においては、術後補助化学療法としてS-1療法が確立している。JASPAC-01試験でのS-1群におけるOS期間の中央値(MST)は46ヵ月である。今回のmodified FOLFIRINOX(mFFX)療法群においては54.4ヵ月とさらなる延長が認められたが、Gemcitabine療法群におけるOS期間のMSTも延長した。全生存期間のハザード比(HR)はJASPAC-01試験で0.57、今回は0.64であった。毒性を考慮すると、本邦での標準補助化学療法はS-1療法と考えられるが、mFFX群でR1切除、N1切除群の成績が良好であったことは興味深い。
(コメント・監修:神奈川県立がんセンター 消化器内科 医長 上野 誠)
Gemcitabine療法に対するmodified FOLFIRINOX(mFFX)療法の優越性を検証
切除後膵癌に対する標準治療は、試験が開始された時点では、Gemcitabine単剤が標準治療であった。一方、遠隔転移を有する膵癌に対しては、FOLFIRINOX療法[Fluorouracil(5-FU)+Leucovorin+Irinotecan+Oxaliplatin]がGemcitabine単剤に対する優越性を示したため、補助化学療法としてもFOLFIRINOX療法の有用性が期待され術後補助化学療法(adjuvant chemotherapy)としてGemcitabine療法に対するFOLFIRINOX療法の優越性を検証する第III相試験が計画された。ただし、FOLFIRINOX療法は毒性が強く、初回から減量して行うmFFX療法が採用された。
本試験は、病理学的に腺癌と診断、R0またはR1切除後3週から12週以内、ECOG PS(performance status) 0/1、CA 19-9<180、臓器機能が維持されている18歳から79歳の患者が対象とされ、mFFX療法群[Leucovorin 400mg/m2+Irinotecan 180mg/m2+Oxaliplatin 85mg/m2(いずれもday 1)+5-FU 2,400mg/m2、2週毎、12サイクル)と、Gemcitabine療法群(1,000mg/m2、day 1,8,15、4週毎、6サイクル)に1:1に割り付けられた。
主要評価項目は無病生存(DFS)期間、副次評価項目は全生存(OS)期間、癌特異的生存[cancer-specific survival(SS)]期間、遠隔転移再発までの[metastasis-free survival(MFS)]期間、有害事象であった。3年DFS率がGemcitabine療法群17%に対してmFFX群27%[ハザード比(HR)=0.74に相当]となることを検証する優越性試験として設計され、両側α=0.05、検出力80%として、490例の登録および342のイベントが必要であった。開始後の30例で、Grade 3以上の下痢が20%に認められたため、以降はIrinotecanの初回投与量が150mg/m2に減量された。
mFFX療法はGemcitabine療法に対して有意にDFS期間を延長
2012年4月から2106年10月までに493例が登録され、mFFX療法群に247例、Gemcitabine療法群に246例が割り付けられた。2018年2月に302例のイベントが観察された時点で早期結果公表が推奨されたため、今回、2018年4月時点(観察期間の中央値33.6ヵ月)のデータが発表された。mFFX療法群とGemcitabine療法群における患者背景は、年齢中央値63歳/64歳、PS 0 49.8%/52.5%、R1切除40.1%/45.7%、門脈合併切除21.3%/28.2%であり、リンパ管腫瘍塞栓のみに群間差を認めた(73.7%/63.1%、p=0.02)。
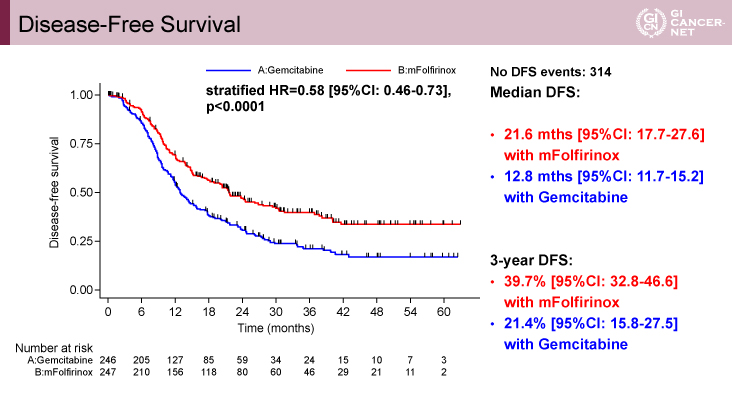
主要評価項目であるDFS期間の中央値は、mFFX療法群21.6ヵ月(95% CI: 17.7–26.7)、Gemcitabine療法群12.8ヵ月(95% CI: 11.7–15.2)、HR=0.58(95% CI: 0.46–0.73、p<0.0001)であり、mFFXの優越性が示された(図1)。
図1 Disease-free survival(発表者の許可を得て掲載)
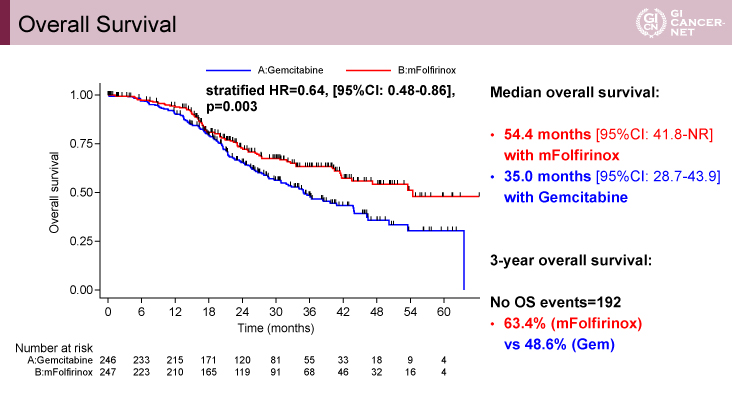
副次評価項目であるOSの中央値(MST)は、mFFX療法群54.4ヵ月(95% CI: 41.8–未到達)、Gemcitabine療法群35.0ヵ月(95% CI: 28.7–43.9)、HR=0.64(95% CI: 0.48–0.86、p=0.003)(図2)、MFS期間の中央値は、mFFX療法群30.4ヵ月(95% CI: 21.7–未到達)、Gemcitabine療法群17.7ヵ月(95% CI: 14.2–21.5)、HR=0.59(95% CI: 0.46–0.75、p<0.0001)、SSはHR=0.63(95% CI: 0.47–0.85、p=0.003)であった。
図2 Overall survival(発表者の許可を得て掲載)
安全性解析対象のmFFX療法群238例とGemcitabine療法群243例におけるGrade 3/4の血液毒性は、好中球数減少28.4% vs. 26.0%、発熱性好中球減少症が2.9% vs. 3.7%と両群に差を認めなかったがG-CSF使用は59.9% vs. 3.7%であり、mFFX療法群で有意に高かった(p<0.001)。Grade 3/4の非血液毒性は、下痢18.6% vs. 3.7%、末梢神経障害9.3% vs. 0%、疲労11.0% vs. 4.6%、嘔吐5.0% vs. 1.2%、口内炎2.5% vs. 0%であり、mFFX療法群で有意に高かった。また、治療完遂率は66.4% vs. 79.0%であった(p=0.002)。
まとめ
切除後膵癌患者に対する術後補助化学療法として、従来の標準治療であるGemcitabine療法に対してmFFX療法は毒性がより強いものの忍容可能であり、DFS期間、OS期間を延長した。少なくとも欧米において、全身状態が良好な患者における標準治療になると考えられる。
(レポート:神奈川県立がんセンター 消化器内科 小林 智)

監修
谷口 浩也先生
愛知県がんセンター中央病院
薬物療法部 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
上野 誠先生
神奈川県立がんセンター
消化器内科 医長
レポーター (50音順)
伊澤 直樹先生
聖マリアンナ医科大学
臨床腫瘍学
大北 仁裕先生
香川大学医学部
腫瘍内科
小林 智先生
神奈川県立がんセンター
消化器内科
佐藤 雄哉先生
国立がん研究センター中央病院
臨床研究支援部門
高橋 直樹先生
埼玉県立がんセンター
消化器内科
寺島 健志先生
金沢大学
先進予防医学研究センター
古田 光寛先生
静岡がんセンター
消化器内科
堀田 洋介先生
埼玉医科大学国際医療センター
消化器腫瘍科