再発高リスクStage II大腸癌に対するOxaliplatin(OX)併用術後補助化学療法の投与期間(3ヵ月vs. 6ヵ月)に関する4つの無作為化試験の前向き統合解析(IDEA collaboration)
Prospective pooled analysis of four randomized trials investigating duration of adjuvant oxaliplatin-based therapy (3 vs 6 months) for patients with high-risk stage II colorectal cancer
Timothy J. Iveson, et al.
監修コメント

山﨑 健太郎先生
静岡県立静岡がんセンター 消化器内科 医長
IDEA collaborationにおけるStage III結腸癌に対するOxaliplatin(OX)併用術後補助化学療法(FOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+OX]またはCAPOX[Capecitabine+OX]療法)の至適期間の検討では、主要評価項目である3ヵ月投与の6ヵ月投与に対する3年無病生存期間(DFS)における非劣性を証明することはできなかった。しかし、あらかじめ計画されていたレジメン別の解析や探索的に行われた再発リスク別の解析より、CAPOX療法を実施する場合、特に再発低リスク(T1-3N1)に対しては3ヵ月投与も治療選択肢になり得るとのコンセンサスが得られ、NCCNガイドラインや日本の大腸癌治療ガイドライン(医師用2019年版)に記載されるようになった。
今回、再発高リスク因子を有するStage II大腸癌に対して同様にOX併用術後補助化学療法の至適投与期間が検討されたが、残念ながら5年DFSにおける3ヵ月投与の非劣性を証明することができなかった。Stage IIIの結果同様、レジメン別の解析ではCAPOX療法であれば3ヵ月投与は6ヵ月投与と同程度の有効性が得られる可能性が示唆されたことから、CAPOX療法3ヵ月投与もオプションになり得ると考えられる。
しかし、Stage IIIでは投与期間別、再発リスク別の3年DFSはレジメン間で同程度もしくはCAPOX療法で良好な傾向にあったが、今回の解析においては、FOLFOX療法6ヵ月投与の5年DFSが最も良好な傾向(64.7%)にあったため、再発高リスクStage IIに対して最適な治療はFOLFOX 6ヵ月であると考える向きもあるかも知れない。発表者も結語で述べているとおり、本研究では無作為に各レジメンに割り付けられているわけではないため、レジメン毎の成績を直接比較することはできないが、前述したような考えもあるため、今後レジメン別の患者背景、特に再発高リスク因子に関する報告が待たれる。また、再発高リスク因子各々の、さらには複数有している場合の再発リスクの検討も必要になるだろう。
現在、大腸癌の再発リスクはTNM分類の因子により規定され広く利用されているが、一部のStage IIの予後がStage IIIAよりも悪いことからもわかるように、臨床病理学的な再発予測には限界があり、今後は分子生物学的な因子も加味したリスク予測の最適化が必要であり、そのうえで至適治療法、期間を検討する必要がある。
(静岡県立静岡がんセンター 消化器内科 医長 山﨑 健太郎)
再発高リスクのStage II大腸癌に対する補助化学療法(adjuvant chemotherapy)の意義と至適投与期間の検討
Stage II大腸癌に対する術後補助化学療法の有用性は本邦では示されておらず、欧米の臨床試験でも全生存期間(OS)を有意に延長することは証明されていない。しかし、Stage IIでも再発をきたしやすい高リスク群が存在することは広く認識されている。本邦のガイドラインでも、再発高リスクのStage II大腸癌に対してStage III大腸癌に準じ、フッ化ピリミジン系薬剤単剤、またはOxaliplatin(OX)併用による術後補助化学療法を実施することは妥当と記載されている。
一方、Stage III結腸癌に対しては同様にFOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+OX]療法もしくはCAPOX(Capecitabine+OX)療法が推奨されており、至適投与期間を検討するIDEA collaborationが発表されている1)。投与期間3ヵ月間と6ヵ月間を比較し、全体の解析では3ヵ月投与の非劣性を証明できなかったが、T1-3かつN1の低リスク群に対してはCAPOX療法での3ヵ月投与が許容される結果となった。
再発高リスクStage II大腸癌に対しての至適投与期間は検討されておらず、IDEA collaboration登録試験のうち、Stage II症例が登録された4つの試験[TOSCA試験(イタリア)、SCOT試験(英国等)、HORG試験(ギリシャ)、ACHIEVE-2試験(日本)]を対象に統合解析が行われた。
無病生存期間(disease-free survival: DFS)を主要評価項目とし、3ヵ月投与の6ヵ月投与に対する非劣性を検討
統合解析は、TOSCA試験、SCOT試験、HORG試験、ACHIEVE-2試験に登録された再発高リスクStage II大腸癌患者を対象とし、OX併用療法(FOLFOX療法またはCAPOX療法、主治医選択)による術後補助化学療法の期間として、3ヵ月投与の6ヵ月投与に対する非劣性を検討した。再発高リスク因子として、T4、低分化、脈管侵襲、リンパ節郭清個数(SCOT試験では10個未満、その他の試験では12個未満)、発症時腸閉塞もしくは穿孔のあった場合と定義された。
主要評価項目は無病生存期間(DFS)とされた。イベントは、大腸癌再発、二次大腸癌、死亡とし、5年DFSが投与6ヵ月群で82.3%から投与3ヵ月群で79.2%の低下を許容し、非劣性マージンは1.2と設定された。80%の検出力、片側α=0.10とし、542のDFSイベントが必要と計算された。その他、レジメン別、T分類別、リンパ節郭清の程度別でのサブグループ解析を行うことが事前に計画された。
3ヵ月投与の6ヵ月投与に対する5年DFSの非劣性は証明されなかった
4試験に3,332例(TOSCA試験1,289例、SCOT試験1,116例、HORG試験413例、ACHIEVE-2試験514例)が登録され、化学療法(FOLFOX療法、CAPOX療法)未施行35例、直腸癌に対しての放射線治療施行24例を除く3,273例を対象に解析が行われた。観察期間中央値は、TOSCA試験64.8ヵ月、SCOT試験60.9か月、HORG試験69.2ヵ月、ACHIEVE-2試験25.6ヵ月であった。
4試験の患者背景において、年齢、性別では大きな偏りは認められず、ECOG PS(performance status)0の割合がTOSCA試験で95%、AHIEVE-2試験で96%と高かった。再発高リスク因子であるT4因子を有する症例はSCOT試験が50%、低分化因子を有する症例はHORG試験が57%、リンパ節郭清個数が不十分であった症例がHORG試験で30%であり、4試験でそれぞれ最も高率であった。レジメンはTOSCA試験ではFOLFOX療法が61%であったが、他の試験ではCAPOX療法が70%以上と高率であった。また、SCOT試験のみ直腸癌が12%登録された(表1)。
有害事象全体(Grade 2、Grade 3-5)の発現頻度は、投与6ヵ月群(以下、6ヵ月群)に比べ投与3ヵ月群(以下、3ヵ月群)で有意に低かった(p<0.0001)。Grade 2では3ヵ月群vs. 6ヵ月群が34% vs. 42%(以下同順)、Grade 3-5では26% vs. 40%であった。末梢神経障害(Grade 2、Grade3-4)の発現頻度は、FOLFOX群(p<0.0001、Grade 2では9% vs. 26%、Grade 3-4では1% vs. 9%)、CAPOX群(p<0.0001、Grade 2では14% vs. 29%、Grade 3-4では2% vs. 8%)ともに有意に低下した。下痢(Grade 2、Grade 3-5)の発現頻度も同様の結果であった。
主要評価項目であるDFSは5年時点で、3ヵ月群80.7% vs. 6ヵ月群83.9%[ハザード比(HR)=1.17、80%信頼区間(CI):1.05-1.31、非劣性p=0.3851)であり、再発高リスクStage II大腸癌全体での非劣性は証明されなかった(図1)。
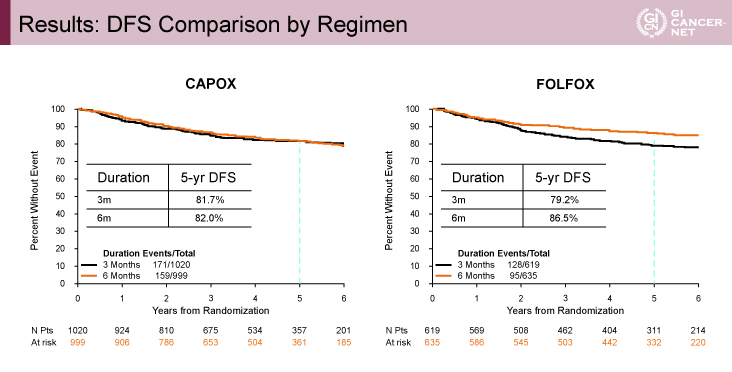
レジメン別サブグループ解析において、5年DFSでは、CAPOX療法は3ヵ月群81.7% vs. 6ヵ月群82.0%、FOLFOX療法は3ヵ月群79.2% vs. 6ヵ月群86.5%であった。HRはCAPOX療法1.018、FOLFOX療法1.408であった(交互作用p=0.20)(図2)。T分類別の検討では、T1-3でHR=1.217、T4でHR=1.094、リンパ節郭清別の検討では、郭清不足群でHR=1.242、郭清群でHR=1.162と、いずれも交互作用を認めなかった。
表1 Results: Patient Characteristics by Study(発表者の許可を得て掲載)
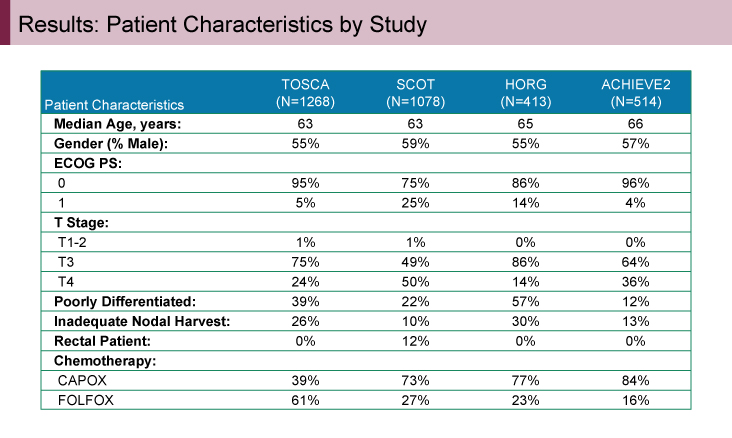
図1 Results: Primary DFS Analysis (mITT)(発表者の許可を得て掲載)
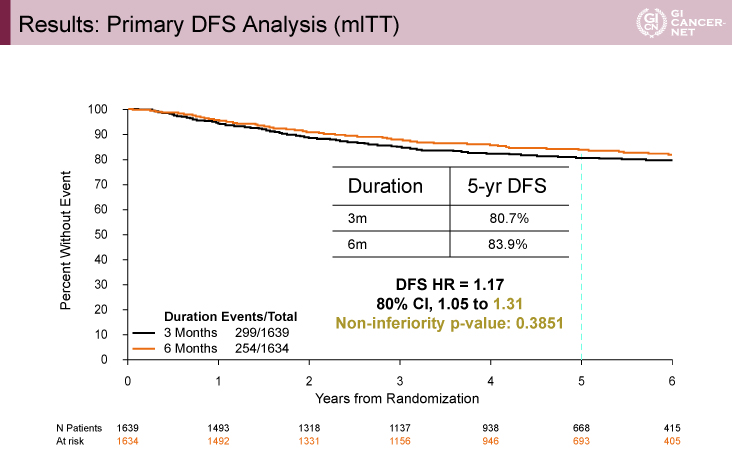
図2 Results: DFS Comparison by Regimen(発表者の許可を得て掲載)
まとめ
再発高リスクStage II大腸癌に対するOX併用術後補助化学療法の投与期間として、3ヵ月投与は6ヵ月投与に対して非劣性を示すことはできなかった。しかし、3ヵ月投与では有害事象が有意に少なく、レジメン別の検討ではStage III大腸癌での検討と同様にCAPOX療法では3ヵ月投与が劣らない傾向が、FOLFOX療法では3ヵ月投与が劣る傾向がみられた。本検討ではレジメン毎の結果を比較することはできないが、CAPOX療法を使用する場合には3ヵ月投与とすることで6ヵ月投与と同様の有効性が得られる可能性があり、かつ有害事象を減少することができる。一方、FOLFOX療法を使用する場合には6ヵ月投与とすることで3ヵ月投与よりも良好な有効性が得られるが、有害事象は有意に高くなる。
(レポート:神戸市立医療センター中央市民病院 腫瘍内科 緒方 貴次)
Reference
1) Grothey A, et al.: N Engl J Med. 378(13): 1177-1188, 2018[PubMed]
関連サイト
・IDEA collaboration[論文紹介][学会レポート(ASCO 2017)][学会レポート(ESMO 2017)]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科