GC[Gemcitabine+Cisplatin(CDDP)]療法歴がある切除不能胆道癌に対する緩和療法(ASC)vs. ASC+mFOLFOX療法の無作為化第III相比較試験(ABC-06試験)
ABC-06 | A randomised phase III, multi-centre, open-label study of active symptom control (ASC) alone or ASC with oxaliplatin / 5-FU chemotherapy (ASC+mFOLFOX) for patients with locally advanced / metastatic biliary tract cancers (ABC) previously-treated with cisplatin / gemcitabine (CisGem) chemotherapy
Angela Lamarca, et al.
監修コメント

寺島 健志先生
金沢大学先進予防医学研究センター 特任准教授
胆道癌も膵癌と同じく分子標的薬の開発が進まない領域のひとつである。最近はBRAF、FGFR2、IDH、HER2、BRCA等をターゲットに稀少フラクションを対象とした治療開発が試みられているが、いずれも日常臨床への導入には時間がかかりそうである。現状は殺細胞性抗癌剤が治療の中心であり、本試験の背景にもあるように二次治療として生存期間の延長を示した薬剤はないものの、本邦では、一次治療でGemcitabine+Cisplatin(CDDP)が投与された患者に対してはS-1が選択されているのが現状である。
本試験結果からは、当該患者に対する二次治療としてmFOLFOX[Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]が標準治療となり得ることは確かであるが、本邦で使用可能となった場合には、S-1との選択については患者の状態等に応じて使い分けることになると考えられる。
一方、2018年のESMOで発表されたように、一次治療でGemcitabine+CDDPにS-1を上乗せすることの有用性が日本から示され、その後もnab-PTX、Nivolumab(Nivo)等を併用したtripletの有用性が報告されているし、FOLFIRINOX[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]については一次治療での有効性も検討されている。Gemcitabine、5-FU、プラチナ系薬剤がkey drugであることに変わりはなく、次の一手の開発が待たれる。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
切除不能胆道癌に対する二次治療として、緩和療法(active symptom control: ASC)+mFOLFOX療法を検討
切除不能胆道癌に対する一次化学療法は、英国で行われた無作為化第III相比較試験(ABC-02試験)1)の結果、GemcitabineとCisplatin(CDDP)の併用療法(GC療法)が標準治療として広く行われている。しかし、その後の二次治療に関しては、その役割も明確ではない。
今回、切除不能胆道癌の二次治療において、ASCにmodified FOLFOX[mFOLFOX:Fluorouracil(5-FU)+Leucovorin(LV)+Oxaliplatin(OX)]を上乗せすることによる有効性と安全性を検討することを目的とした無作為化第III相比較試験(ABC-06試験)が実施された。
全生存(OS)期間を主要評価項目に設定
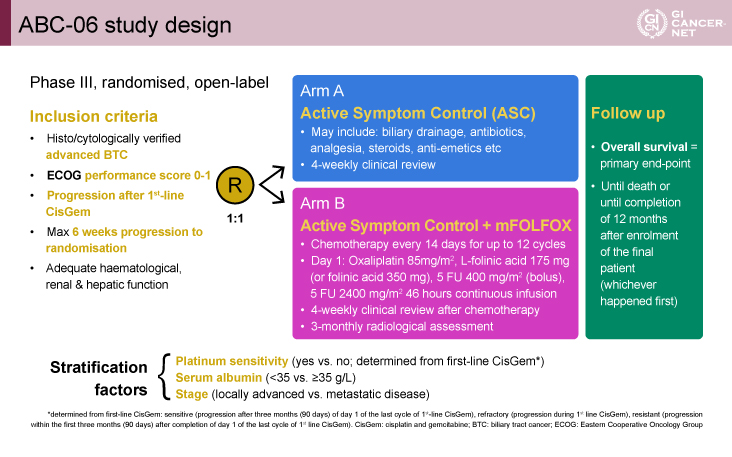
本試験の主な適格基準は、1)病理組織学的に診断された進行胆道癌、2)ECOG PS(performance status)0-1、3)一次化学療法として施行したGC療法後に進行、4)腫瘍増悪から無作為化までの期間が6週以内、5)十分な骨髄機能、腎機能、肝機能を有していること、とされた。登録された患者は、4週毎の臨床評価によるASC群と、ASC+mFOLFOX療法群(2週間を1サイクルとして、OX 85mg/m2、L-folinic acid 175mg/m2またはfolinic acid 350mg、5-FU急速静注400mg/m2をday 1に投与後、5-FU 2,400mg/m2を46時間かけて投与、以下mFOLFOX療法群)に、1:1で割り付けられた。
層別化因子としてプラチナ感受性(ありvs.なし)、血清アルブミン値(<3.5g/dL vs. ≧3.5g/dL)、Stage(局所進行vs.遠隔転移)が設定された。なおプラチナ感受性は、一次化学療法のGC療法における感受性から決定した。GC療法の最終コース投与開始時より90日以降の病勢進行(progression)を感受性あり、投与中あるいは最終コース投与開始時より90日以内の病勢進行を感受性なしとした(図1)。
主要評価項目には全生存(OS)期間が設定された。ASC群のOS期間中央値を4ヵ月、ハザード比(HR)を0.63と仮定、有意水準両側5%、検出率80%と設定し、必要イベント数148として必要症例数は162例と算出された。
副次評価項目は無増悪生存(PFS)期間、radiological response(RR)、有害事象、QOL(quality of life)、医療経済、トランスレーショナルリサーチであった。
図1 ABC-06 study design(発表者の許可を得て掲載)
mFOLFOX療法群はASC群に対し、全生存(OS)期間における優越性を示した
本研究は英国の20施設において、2014年3月から2018年1月まで実施された。最終的に162例が各群81例ずつに割り付けられた。患者背景に関しては、プラチナ感受性のある患者がASC群にやや多く認められたが(ASC群42% vs. mFOLFOX療法群33%)、そのほかに群間差は認められなかった。
主要評価項目のOS期間に関しては、プラチナ感受性、血清アルブミン値、病勢進行で調整したHRは0.69[95%信頼区間(CI):0.50-0.97]と、mFOLFOX群で有意に良好であった(p=0.0031)。また、OS期間中央値はASC群5.3ヵ月vs. mFOLFOX群6.2ヵ月、6ヵ月OS割合はASC群35.5% vs. mFOLFOX群50.6%、12ヵ月OS割合はASC群11.4% vs. mFOLFOX群25.9%と、いずれもmFOLFOX療法群で良好であった(図2)。
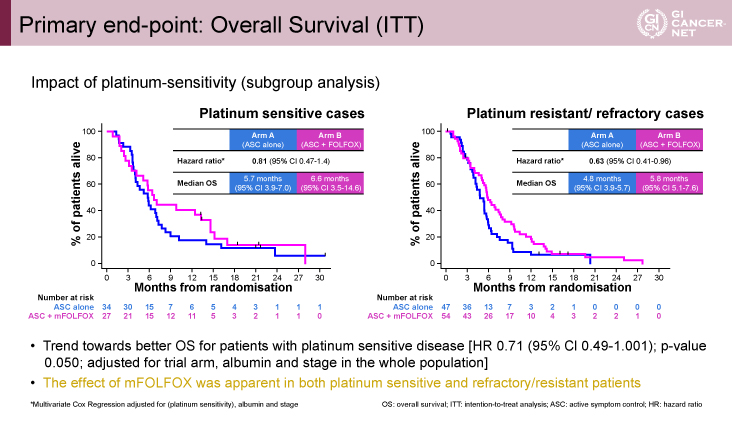
さらに、サブグループ解析では、OS期間はいずれのサブグループにおいてもmFOLFOX療法群で良好な傾向を示した。特に一次化学治療におけるプラチナ感受性にかかわらず同様の結果が得られたことから、二次治療におけるmFOLFOX療法の有効性が確認された(図3)。
副次評価項目のPFS期間およびRRに関しては、3ヵ月毎の画像による効果判定を実施したmFOLFOX療法群でのみ検討されたが、それぞれPFS期間中央値が4.0ヵ月(95% CI: 3.2-5.0)、RRが5%[うち完全奏効(CR)1%]、病勢コントロール割合(DCR)が33%という結果であった。三次治療移行率はASC群で15%、mFOLFOX療法群で12%であった。
一方、有害事象に関してはGrade 3または4の有害事象は、ASC群40%、mFOLFOX療法群59%に認められた。とくに、倦怠感(7% vs. 19%)、好中球数減少(0% vs. 12%)、感染症(1% vs. 18%)はmFOLFOX療法群に多くみられたが、いずれも許容範囲内のものであった。
図2 Primary end-point: Overall Survival (ITT)(発表者の許可を得て掲載)
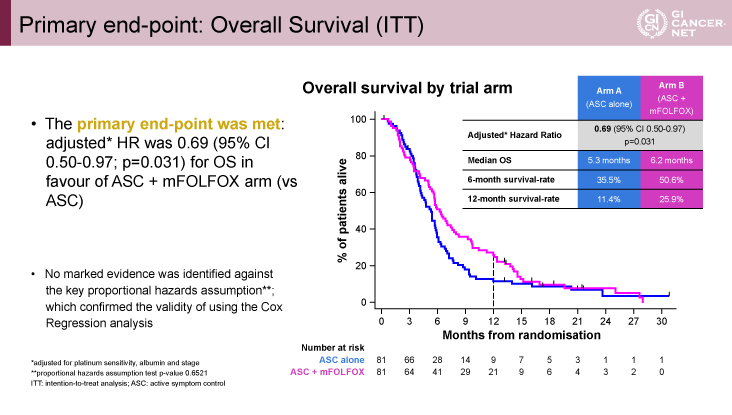
図3 Primary end-point: Overall Survival (ITT). Impact of platinum-sensitivity (subgroup analysis)(発表者の許可を得て掲載)
まとめ
GC療法で進行が認められた切除不能胆道癌に対する二次治療として、ASCへのmFOLFOX療法の上乗せは有意なOS期間の延長効果を示し、新たな標準治療になり得ると考えられた。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
Reference
1) Valle J, et al.: N Engl J Med. 362(14): 1273-1281, 2010[PubMed]
関連サイト
・ABC-06試験[ClinicalTrials.gov]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科