進行肝細胞癌(HCC)に対するNivolumab(Nivo)+Ipilimumab(IPI)併用療法の結果(CheckMate 040試験)
Nivolumab + Ipilimumab combination therapy in patients with advanced hepatocellular carcinoma: Results from CheckMate 040
Thomas Yau, et al.
監修コメント

寺島 健志先生
金沢大学先進予防医学研究センター 特任准教授
本サイトでは残念ながら詳細を紹介できないが、本年のASCOにおいて、肝細胞癌(hepatocellular carcinoma: HCC)に対する二次治療として、Pembrolizumab単独投与の有用性をプラセボと比較した無作為化比較試験の結果が発表され(Oral Abstract #4004:KEYNOTE-240)、primary endpointに設定された無増悪生存(PFS)期間、全生存(OS)期間ともに有望な結果であったものの、事前に設定された有意水準を下回ることができなかった。また、二次治療以降で、米国FDAからNivolumab(Nivo)とPembrolizumabがaccelerated approvalされている米国と、いずれも未承認の本邦とでは医療環境が異なる点でも、本結果の解釈には注意が必要である。
NivoとIpilimumab(IPI)の併用投与は既に本邦でも悪性黒色腫と腎細胞癌において承認されているが、それぞれ用法・用量が異なる。本試験におけるNivo 1mg/kgとIPI 3mg/kgの併用投与は悪性黒色腫と同様であり、50例の二次治療以降のOS期間中央値が22.8ヵ月という数字は極めて有望な結果といえる。
本邦における今後の展開は、そろそろ結果の公表が予定されているCheckmate 459(一次治療におけるNivo vs. Sorafenib)や免疫チェックポイント阻害薬(ICI)と分子標的薬との併用投与の成績をみながら進められることになろう。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
CheckMate 040の拡大コホートとしてのNivolumab(Nivo)+Ipilimumab(IPI)併用療法
免疫チェックポイント阻害薬(ICI)であるNivoによる免疫療法はさまざまな癌種において生存期間延長効果を示している。肝細胞癌(hepatocellular carcinoma: HCC)においても、進行HCC患者を対象としたNivo単剤の安全性および有効性を検討する非比較、オープンラベル、第I/II相試験であるCheckMate 040試験が行われた。この結果1)に基づき、2017年9月22日に、NivoはSorafenibによる治療歴を有するHCCに対して米国FDAに迅速承認されている。
本試験は、他癌種で有効性が示されているNivoとCTLA-4(cytotoxic T-lymphocyte-associated protein 4)チェックポイント阻害薬であるIPIとの併用療法の第I/II相試験であり、CheckMate 040の拡大コホートとして計画された。
安全性、忍容性、奏効割合(ORR)、奏効期間(DOR)が主要評価項目
対象は、Sorafenib不応または不耐のChild-Pugh分類A、ECOG PS(performance status)0-1で、組織学的に診断された進行HCC患者で、以下の3群(A群:Nivo 1mg/kg+IPI 3mg/kg 3週毎の投与、4サイクル後Nivo 240mgを2週毎、B群:Nivo 3mg/kg+IPI 1mg/kg 3週毎の投与、4サイクル後Nivo 240mgを2週毎、C群:Nivo 3mg/kg 2週毎+IPI 1mg/kg 6週毎の投与)に1:1:1で割り付けられた。
主要評価項目は安全性、忍容性、ORR、DOR、副次評価項目は病勢コントロール割合(DCR)、無増悪(TTP)期間、無増悪生存(PFS)期間、奏効までの期間(TTR)、全生存(OS)期間であった。本試験はCheckMate 040試験の拡大コホートであり、統計学的仮説は設定されなかった。
Nivo+IPI併用療法の有効性、安全性が示唆された
最終的に、148例(A群50例、B群49例、C群49例)が登録され、3群間で患者背景に差は認めなかった。
主要評価項目であるORRは(以下、A群、B群、C群の順)、32%[完全奏効(CR):8%]、31%(CR:6%)、31%(CR:0%)、DOR中央値は、17.5ヵ月、22.2ヵ月、16.6ヵ月であった。
副次評価項目であるDCRは、54%、43%、49%、TTR中央値は、2.0ヵ月、2.6ヵ月、2.7ヵ月であり、各群に差は認めなかった。OS期間中央値は、22.8ヵ月、12.5ヵ月、12.7ヵ月であった(表1)。
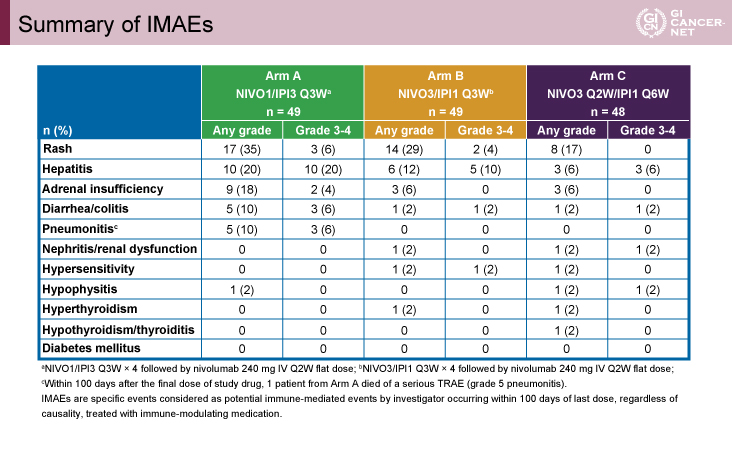
全Gradeの治療関連有害事象の発現率は、94%、71%、79%であった(表2)。A群でやや高率であったが、発現がみられた有害事象のタイプは各群でほぼ同様であった。免疫関連有害事象はいずれの群でも皮疹、肝炎、副腎不全が多くみられた(表3)。肝炎はA群における発現率がもっとも高率であったものの、90%は6.6週で改善していた。
表1 Response, disease control, and durability(発表者の許可を得て掲載)
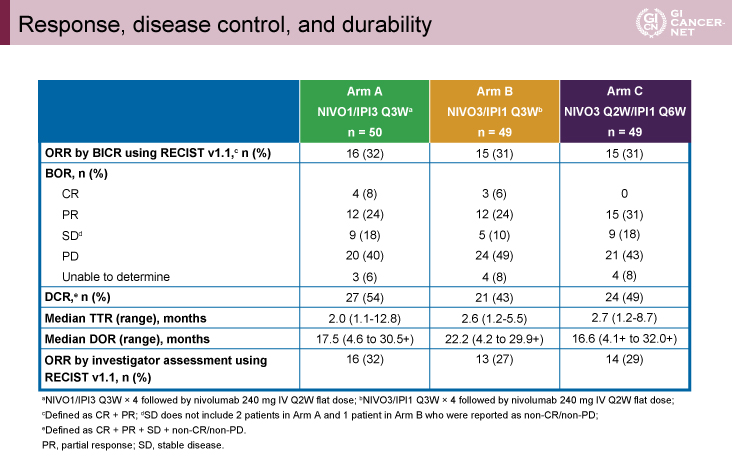
表2 Summary of TRAEs(発表者の許可を得て掲載)
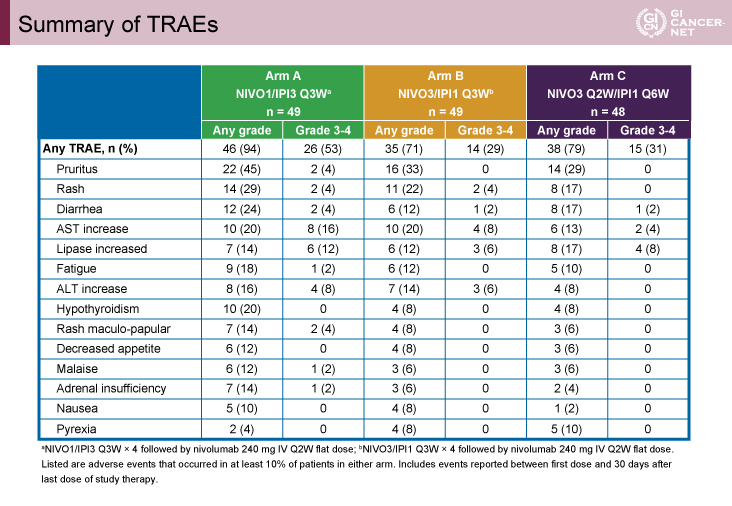
表3 Summary of IMAEs(発表者の許可を得て掲載)
まとめ
Nivo+IPI併用療法は、Nivo単独療法より有効、かつ安全性においても許容範囲な治療である可能性が示唆された。
Nivo+IPI併用療法における各薬剤の至適用量については、癌種によって異なると考えられており、今後、さらなる検証が望まれる。
(レポート:がん研有明病院 肝・胆・膵内科 尾阪 将人)
Reference
1) El-Khoueiry AB, et al.: Lancet. 389(10088): 2492-2502, 2017[PubMed]
関連サイト
・CheckMate 040[ClinicalTrials.gov][Journal of Clinical Oncology][論文紹介]
・Oral Abstract #4004:KEYNOTE-240[ClinicalTrials.gov][Journal of Clinical Oncology]
・CheckMate 459[ClinicalTrials.gov][Journal of Clinical Oncology]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科