生殖細胞系列BRCA遺伝子変異と転移を有する膵癌におけるプラチナ系薬剤をベースとした一次化学療法後の維持療法としての、Olaparib(OLP)の有効性を検証する第III相試験(POLO試験)
Olaparib as maintenance treatment following first-line platinum-based chemotherapy in patients with a germline BRCA mutation and metastatic pancreatic cancer: Phase III POLO trial
Hedy Lee Kindler, et al.
監修コメント

寺島 健志先生
金沢大学先進予防医学研究センター 特任准教授
今年のASCOでは久しぶりにplenary sessionで肝胆膵領域の演題が選ばれた。膵癌に対する薬剤開発では、Erlotinib(ERL)を除き分子標的治療薬はことごとく失敗し、現在はFOLFIRINOX[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]療法またはGemcitabine(GEM)+nab-Paclitaxel(nab-PTX)といった殺細胞性抗癌薬が標準治療であり、GEM+ERLも既に標準治療ではなくなっている。
POLO試験は、膵癌領域で初めて患者をエンリッチした第III相試験で有用性を検証した試験である。新規薬剤の開発成功以上に、この開発に成功したことによって新たな疾患entityが確立されたことに大きな意義がある。胃癌領域にHER2陽性胃癌の概念が導入された経緯と似ている。
残念ながら日本人は本試験に参加しなかったことから、承認に向けては何らかの国内試験が必要となるが、さらに、本邦での導入にあたっては2つのハードルがあると考える。1つは、遺伝子の生殖細胞系列変異を調べるハード面およびソフト面の体制整備の必要性であり、もう1つは、日本人におけるBRCA1またはBRCA2の陽性患者がどれくらいいるか不明だという問題である。折しも2019年度よりBRCA1およびBRCA2ゲノム検査(がん遺伝子パネル検査)が保険償還されたのと同じタイミングで本試験の結果が発表され、ゲノム中核病院等の整備も進められている。海外にやや遅れをとることになるとは考えられるが、PARP[poly (ADP-ribose) polymerase]阻害剤はBRCA1またはBRCA2のみならず、その他のHRR遺伝子変異を有する患者や遺伝子の生殖細胞系列(germline)変異ではなく体細胞系列(somatic)変異がある場合にも有効性が期待されており、Poster Abstract #4014で示されたVeliparib(ABT-888)をはじめ、今後の開発が期待される。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
生殖細胞系列(germline)のBRCA遺伝子変異を有する膵癌に対して、PARP阻害剤の有用性が示唆されている
膵癌患者の約4%から7%でBRCA1かつ/またはBRCA2に生殖細胞系列(germline)遺伝子異常が認められ1)、これらの遺伝子異常を有する患者に対しては、プラチナ系薬剤を含んだ薬物療法の有効性が示唆されている。また、PARP[poly (ADP-ribose) polymerase]阻害剤が、合成致死を介したDNA修復機能の完全な不活化による抗腫瘍効果を発揮することが示唆されている2)。
本試験は、生殖細胞系列のBRCA遺伝子変異と転移を有する膵癌患者を対象に、プラチナ系薬剤を含んだ一次化学療法後の維持療法としてPARP阻害剤Olaparib(OLP)の有効性を検証することを目的とした無作為化第III相比較試験である。
主要評価項目に、中央判定による無増悪生存(PFS)期間を設定
本試験の主な適格基準は、転移を有する膵癌であること、BRACAnalysis CDxテストで病因となるあるいは病因となることが疑われる生殖細胞系列遺伝子BRCA1またはBRCA2に変異を有することが確認されていること、一次化学療法としてプラチナ系薬剤をベースとした化学療法を病勢進行なく16週間以上施行していることであった。
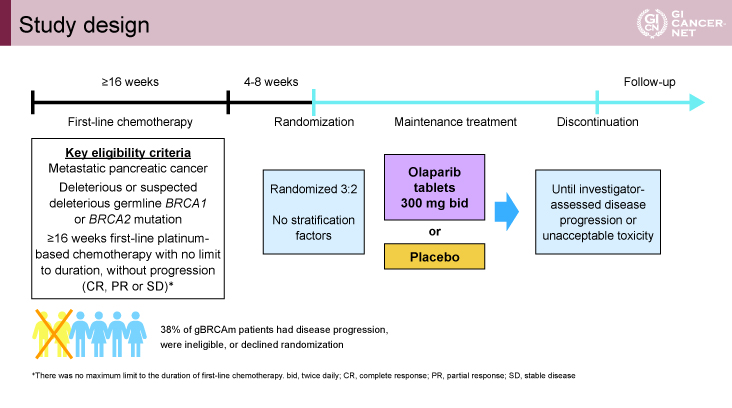
登録された患者は、一次治療における最終化学療法施行時から4~8週後に維持療法OLP群(300mg、1日2回)とプラセボ群に3:2で割り付けられ、腫瘍の増悪または許容されない毒性の発現まで継続することとされた。なおプラセボからOLPへのクロスオーバーは認められなかった(図1)。
主要評価項目には、独立盲検中央判定によるPFS期間が設定された。ハザード比(HR)0.54と仮定し、有意水準片側2.5%、検出率80%と設定し、必要イベント数87として必要症例数は145例と算出された。なお、PFS期間解析時に全生存(OS)期間の中間解析が事前に予定された。
副次評価項目はOS期間、無作為化から二次病勢進行時までの無再発生存(PFS2)期間、奏効割合(ORR)、健康関連quality of life(QOL)、安全性であった。
図1 Study design(発表者の許可を得て掲載)
維持療法としてのOLPは、プラセボと比較してPFS期間における優越性を示した
本試験は欧米を中心とした12ヵ国の119施設で実施され、3,315症例がスクリーニングされ、247例(7.5%)で生殖細胞系列のBRCA遺伝子に変異が検出された。最終的に2015年1月から2019年1月までの間に154例が登録され、OLP群に92例、プラセボ群に62例が割り付けられた。患者背景に関しては、両群に群間差は認められなかった。
両群ともに、一次化学療法としてはFOLFIRINOX[Fluorouracil(5-FU)+Leucovorin(LV)+Irinotecan(IRI)+Oxaliplatin(OX)]療法が多く(OLP群85.9%、プラセボ群80.6%、以下同順)、一次化学療法継続期間の中央値は5.0ヵ月、5.1ヵ月、ORRは50.0%、48.4%であった。
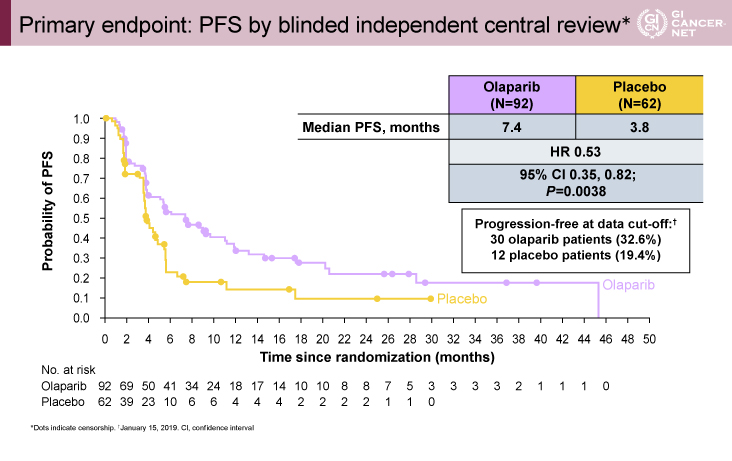
主要評価項目のPFS期間中央値はOLP群7.4ヵ月vs.プラセボ群3.8ヵ月、HR=0.53[95%信頼区間(CI):0.35-0.82]とOLP群で有意に良好であった(p=0.0038)(図2)。また、6ヵ月PFS割合はそれぞれ53% vs. 23%、12ヵ月PFS割合は34% vs. 15%と、いずれもOLP群で良好であった。さらに、部分集団解析では、PFS期間はいずれのサブグループにおいてもOLP群で良好な傾向を示し、特に一次化学療法の治療継続期間や奏効にかかわらず有効性が確認された。
副次評価項目のOS期間に関してはイベント発生が46%の時点における中間解析の結果、HR=0.91(95% CI: 0.56-1.46)、OS期間中央値はOLP群18.9ヵ月、プラセボ群18.1ヵ月と両群間に有意な差は認められなかった。ORRに関してはOLP群23.1%(2例の完全奏効を含む)、プラセボ群11.5%であり、奏効期間(DR)中央値はOLP群24.9ヵ月、プラセボ群3.7ヵ月であった。またEORTC QLQ-C30で評価した健康関連QOLに関しては、両群ともに治療期間を通じてベースライン時よりQOLスコア(0-100点)に臨床的に意義のある変化(10点以上の増減)は認められず、群間差も認められなかった(群間差-2.47点、95% CI: -7.27-2.33、p=0.31)。
一方、安全性に関してはGrade 3以上の有害事象がOLP群39.6%、プラセボ群23.3%に認められた。とくに、貧血(11.0% vs. 3.3%)、疲労(5.5% vs. 1.7%)がOLP群に多く認められたが、有害事象のために治療中断した症例はそれぞれの群で5.5%、1.7%といずれも許容範囲内のものであった。
図2 Primary endpoint: PFS by blinded independent central review(発表者の許可を得て掲載)
まとめ
生殖細胞系列のBRCA遺伝子変異と転移を有する膵癌におけるプラチナ系薬剤をベースとした一次化学療法施行後のOLPによる維持療法は、プラセボに対し、PFS期間の有意な延長効果を示した。本試験は、膵癌に対するゲノムバイオマーカーに基づく薬物療法の有用性を検証した初の無作為化第III相比較試験であり、当該患者に対してOLPによる維持療法は、新たな標準治療のひとつになり得ると考えられた。
追記
ASCO 2019では、膵癌に対するPARP阻害剤の前向き臨床試験に関する演題が本演題を含めて3演題報告された。
1つは、転移を有する膵癌に対する二次治療におけるFOLFIRI(5-FU+LV+IRI)療法へのPARP阻害剤(Veliparib)の上乗せ効果をみた無作為化第II相試験の報告(Poster Abstract #4014)である。主要評価項目のOS期間および副次評価項目のPFS期間について、全症例ではVeliparibの上乗せ効果は認められなかった。しかし、全体の20%に相当するHRD(homologous recombination deficiency)関連遺伝子変異を有する症例[22例/107例:生殖細胞系列(germline)11%、体細胞系列(somatic)9%]においてはOS期間、PFS期間ともにVeliparibの上乗せ効果を認める傾向にあったことが報告された。
もう1つは、転移を有する膵癌に対するFOLFOX(5-FU+LV+OX)療法にVeliparibを併用した第I/II相試験の報告(Poster Abstract #4015)である。主要評価項目のORRは全症例では26%であったが、生殖細胞系列あるいは体細胞系列にHRD関連遺伝子変異を有する症例においては58%まで上昇することが報告された。
これらの結果から、今後、膵癌におけるPARP阻害剤の有効性を示唆するゲノムバイオマーカーとして、BRCA遺伝子を含めたHRD関連遺伝子における遺伝子変異の検索が重要であり、また生殖細胞系列のほか、体細胞系列に遺伝子変異を有する症例を含めた検証が必要と考えられた。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
1) Holter S, et al.: J Clin Oncol. 33(28): 3124-3129, 2015[PubMed]
2) Gourley C, et al.: J Clin Oncol. May 3, 2019 [Epub ahead of print][PubMed]
関連サイト
・POLO試験[ClinicalTrials.gov]
・ASCO 2019 Poster Abstract #4014[Abstract][ClinicalTrials.gov][Journal of Clinical Oncology][SWOG CANCER RESEARCH NETWORK]
・ASCO 2019 Poster Abstract #4015[Abstract][ClinicalTrials.gov]

監修
谷口 浩也先生
国立がん研究センター東病院
消化管内科 医長
加藤 健先生
国立がん研究センター中央病院
消化管内科 医長
山﨑 健太郎先生
静岡県立静岡がんセンター
消化器内科 医長
寺島 健志先生
金沢大学先進予防医学研究センター
特任准教授
レポーター (50音順)
井上 博登先生
静岡がんセンター
消化器内科
大隅 寛木先生
がん研有明病院
消化器化学療法科
緒方 貴次先生
神戸市立医療センター中央市民病院
腫瘍内科
尾阪 将人先生
がん研有明病院
肝・胆・膵内科
川本 泰之先生
北海道大学病院
消化器内科
林 秀幸先生
慶應義塾大学病院
腫瘍センター
深堀 理先生
久留米大学病院
がん集学治療センター
三島 沙織先生
国立がん研究センター東病院
消化管内科