進行性GISTを有する患者を対象とする経口HSP90阻害剤Pimitespib(TAS-116)のプラセボ対照二重盲検無作為化比較第III相試験(CHAPTER-GIST-301)
Randomized, double-blind, placebo-controlled, phase III trial of pimitespib (TAS-116), an oral HSP90 inhibitor, in patients with advanced GIST (CHAPTER-GIST-301)
Yoshitaka Honma, et al.
監修コメント
GISTの治療は、Imatinibを初回治療とし、その後Sunitinib、Regorafenibと続く。トータルの治療期間は、数年にわたる治療期間となるが、治癒まで至る症例は多くない。Imatinibによる無増悪生存期間(PFS)は2年前後であるが、その後のSunitinib、RegorafenibのPFSは4~6ヵ月程度であり、その後のいわゆるsalvage lineの治療の開発が望まれていた。FDAでは、2020年にKIT/PDGFRA阻害剤である、RipretinibおよびAvapritinibが承認されているが、本邦での承認のめどはたっていないのが現状である。
Pimitespibは、ストレス応答蛋白であるHSP90の阻害剤である。HSP90を阻害して、細胞をアポトーシスに誘導することで、細胞障害性を発揮する。CHAPTER-GIST-301試験では、Imatinib、Sunitinib、Regorafenibといった標準治療に不応となったGIST患者を対象に、プラセボと2:1の割り付けで行われ、腫瘍増悪後には、盲検解除が行われ、研究者判断によるPimitespibの投与が行われた。結果、プラセボ群において22例中17例が実薬の投与を受けている。主要評価項目は中央判定によるPFSであり、プラセボ群PFS中央値1.4ヵ月に対して、Pimitespib群2.8ヵ月と有意な延長(HR=0.51)を認めた。クロスオーバーが許容されているが、全生存期間(OS)は最初からPimitespibの投与を受けた群が良好な傾向にあった。
Salvage lineのGISTの治療選択肢として、Imatinibの再投与も実地臨床で行われているが、その根拠となっているRIGHT試験において、PFS中央値がプラセボ0.9ヵ月、再投与Imatinibが1.8ヵ月、HR=0.46であったことを考えると、Pimitespibとプラセボの差は、臨床的に意味のある差であると考えられる。
毒性については、grade 3以上の下痢や、食欲不振などの消化器系の毒性が認められるが、その多くは休薬や、止痢薬、制吐薬でコントロール可能であり、許容される範囲であると考えられる。一方で、頻度は少ないものの、夜盲症などの特徴的な有害事象が認められ、実臨床に導入された場合には、定期的な眼科受診などの配慮が必要と考えられた。
GISTはKIT、PDGFRA遺伝子変異により薬剤の有効性が異なったり、二次的な変異による薬剤耐性が起こったりすることが知られている。今回の報告では、血液中のDNAによる変異ステータスが背景として報告されているが、両群で差異はなく、また、二次的変異があった集団においても、全体集団と同様に、Pimitespibの有効性があることが示されている。
本試験の結果により、GISTのsalvage lineにPimitespibが承認され、患者さんにとって治療選択肢が増えることが期待される。また、作用機序の異なる薬剤の出現により、より前のラインでの評価や、併用療法による評価など、今後の開発に期待が集まる。
(国立がん研究センター中央病院 頭頸部・食道内科 科長 加藤 健)
Imatinib・Sunitinib・Regorafenib不応・不耐の進行性GISTに対する治療法は本邦において確立されていない
KITやPDGFRAの機能獲得変異はGISTの発症に重要な役割を担い、約80%、約10%のGISTがKIT、PDGFRAの遺伝子変異を有する1,2)。進行性GISTの治療戦略はチロシンキナーゼ阻害薬(TKI)の登場によって大きな変革がもたらされた。3つのTKI(Imatinib・Sunitinib・Regorafenib)が本邦の保険承認を得ている。一方で、Imatinib・Sunitinib・Regorafenibに不応・不耐である進行性GISTに対する治療法は本邦において確立されておらず(Ripretinib、Avapritinibは本邦未承認)、新規治療の開発が求められている。
Pimitespib(TAS-116)は、HSP90を選択的に阻害する経口抗がん剤である3)。Imatinib・Sunitinib・Regorafenibに不応の進行性GISTを対象とした国内第II相試験において、無増悪生存期間(PFS)中央値4.4ヵ月と良好な治療成績が示された4)。
CHAPTER-GIST-301試験は、Imatinib・Sunitinib・Regorafenibに不応の進行性GISTを対象として、Pimitespibの有効性と安全性を検証した国内プラセボ対照二重盲検無作為化比較第III相試験である。
標準治療不応の進行性GISTを対象としてプラセボに対するPimitespibの優越性を検証
測定可能病変を有し、ECOG PS 0-1の、Imatinib・Sunitinib・Regorafenibに不応である進行性GIST患者が、Pimitespib群とプラセボ群へ2:1で割り付けられた。いずれの群も21日間を1サイクルとして、Pimitespibまたはプラセボ160mg/日が1~5日目および8~12日目に投与された。盲検独立中央判定(BCRR)によって病勢進行と判定された患者では、非盲検下でPimitespibの投与が可能であった。
主要評価項目は腫瘍内部の性状変化も加味したmodified RECIST v1.1に基づくBCRR(中央画像判定)によるPFS、副次評価項目は全生存期間(OS)、プラセボからPimitespibにクロスオーバーした患者群におけるPFS(secondary PFS)、ファーマコゲノミクス、および安全性であった。クロスオーバー調整後のOSはrank preserving structural failure time(RPSFT5))モデルを用いて解析された。
主要評価項目であるPFSにおいて、Pimitespib群はプラセボ群と比較して統計学的に有意な延長を示した
86例の患者が無作為化され、58例がPimitespib群に、28例がプラセボ群に割り付けされた。Pimitespib群のうち、50例が治療を終了(39例がBCRRによって病勢進行と判定)し、1例が非盲検下でPimitespib投与を継続した。プラセボ群では、24例が治療を終了(22例がBCRRによって病勢進行と判定)し、17例が非盲検下でのPimitespib投与にクロスオーバーした。患者背景および末梢血解析に基づくKIT/PDGFRAの遺伝子変異ステータスでは、群間で大きな違いは認められなかった(表1)。
主要評価項目であるPFSにおいて、Pimitespib群はプラセボ群と比較して統計学的に有意な延長を示した(PFS中央値:Pimitespib群2.8ヵ月vs.プラセボ群1.4ヵ月、ハザード比[HR]=0.51、p=0.006[層別ログランク検定])(図1)。KIT exon 13・14・17・18の遺伝子変異が末梢血に認められたサブグループにおいても、Pimitespib群の治療成績が良好であった(HR=0.52)。Secondary PFSの中央値は2.7ヵ月であった。
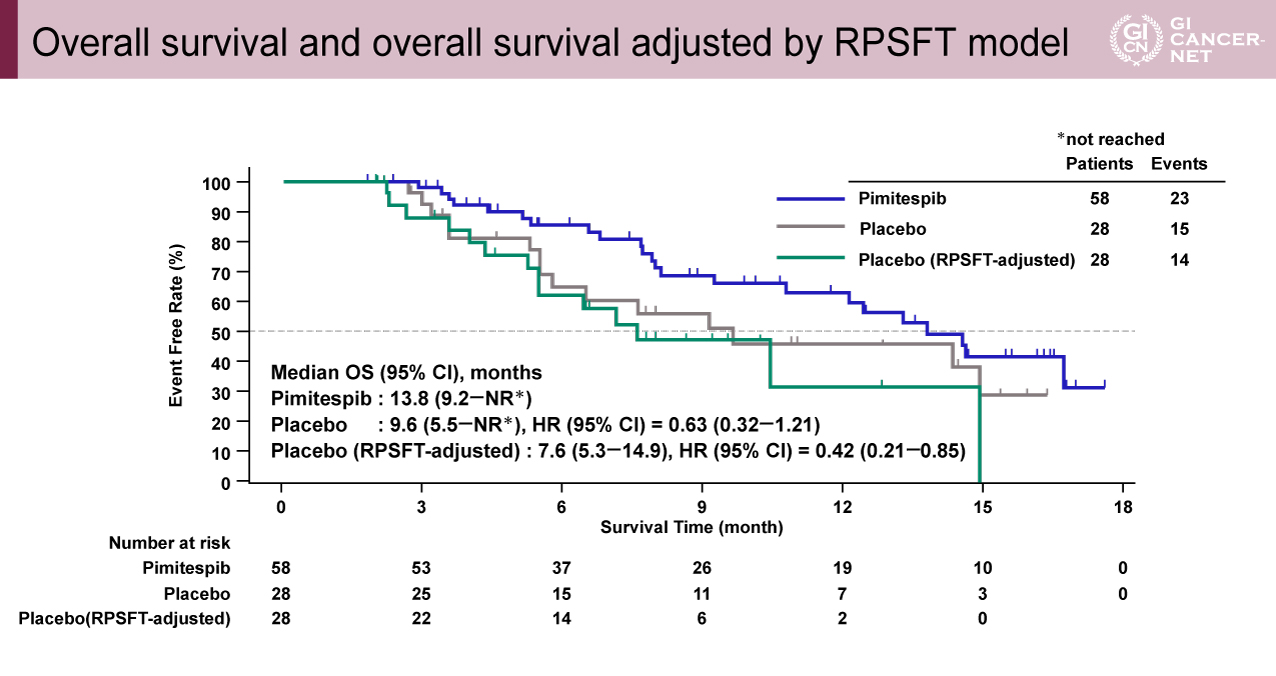
OSについても、Pimitespib群はプラセボ群(RPSFT調整なし)およびプラセボ群(RPSFT調整あり)と比較して良好な結果であった(OS中央値:Pimitespib群13.8ヵ月vs.プラセボ群[RPSFT調整なし]9.6ヵ月、HR=0.63;Pimitespib群13.8ヵ月vs.プラセボ群[RPSFT調整あり]7.6ヵ月、HR=0.42)(図2)。
両群において奏効割合は0%であった。病勢制御割合はPimitespib群62.1%、プラセボ群35.5%であった。
表1 Baseline characteristic and genomic status(発表者の許可を得て掲載)
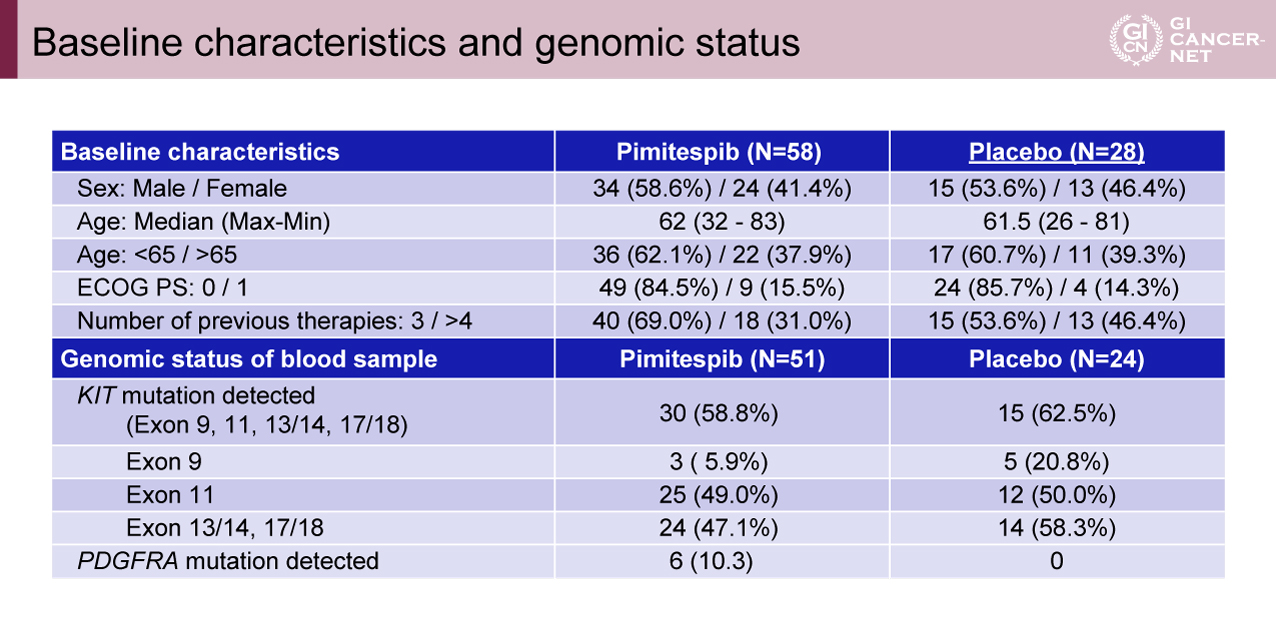
図1 Progression-free survival based on BCRR(発表者の許可を得て掲載)
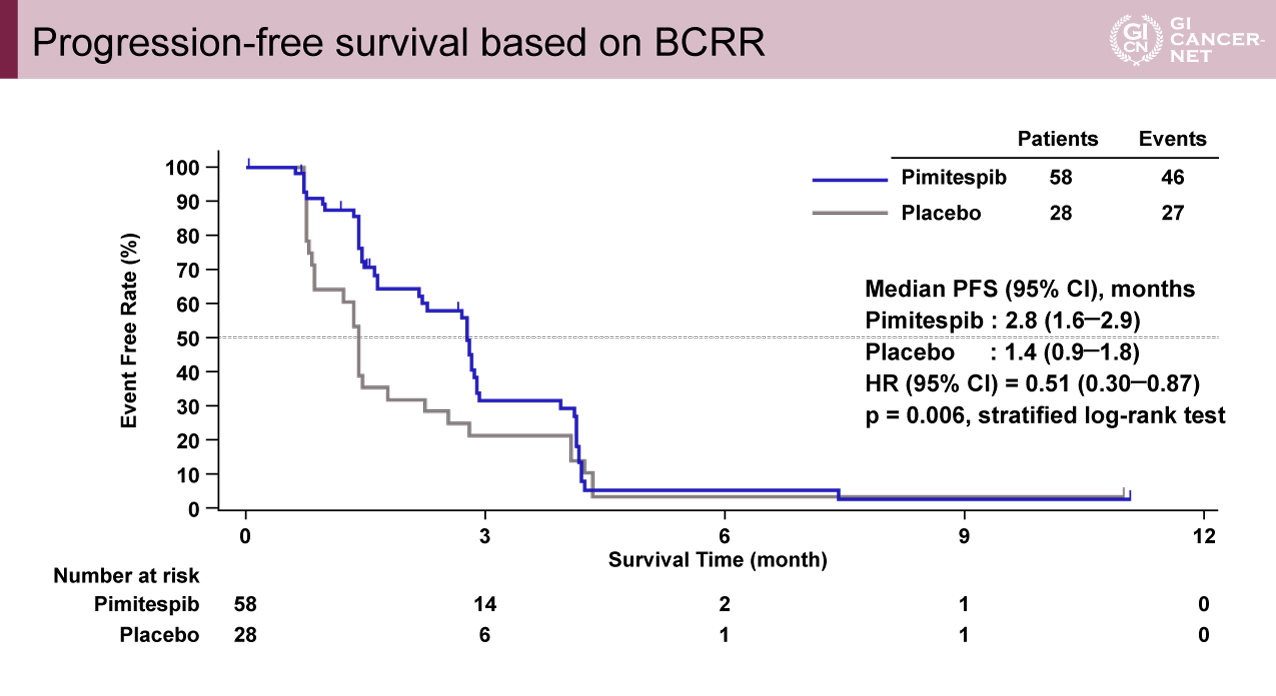
図2 Overall survival and overall survival adjusted by RPSFT model(発表者の許可を得て掲載)
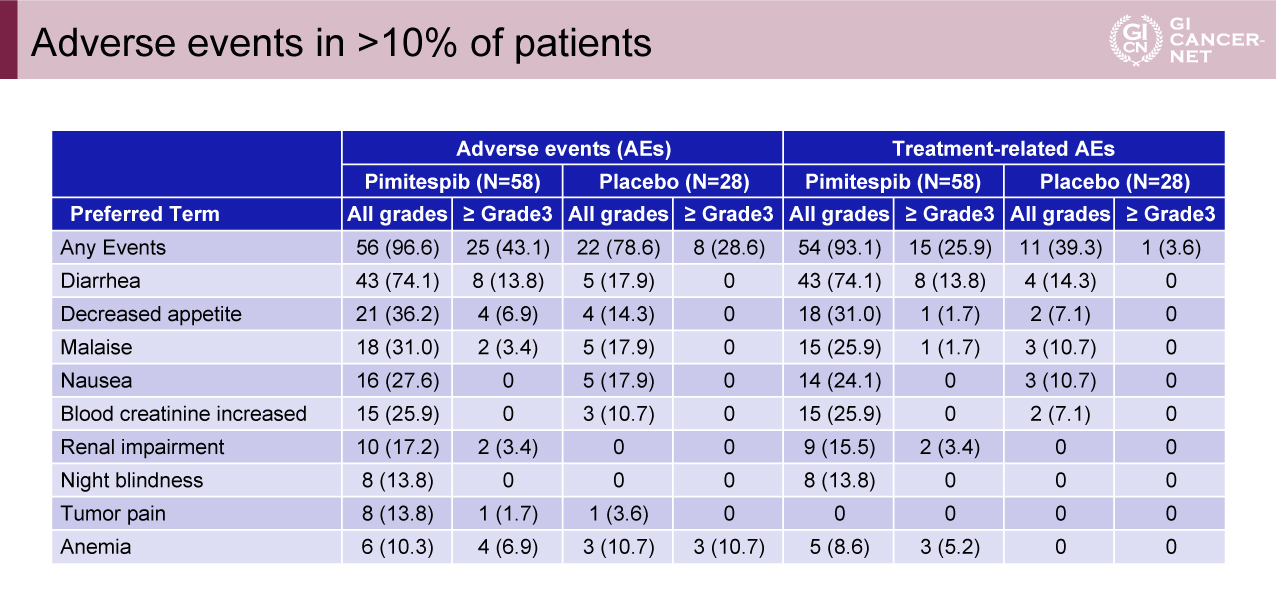
主な有害事象
Pimitespib群でgrade 3以上の有害事象が多く認められた(Pimitespib群43.1% vs.プラセボ群28.6%)(表2)。Pimitespib群で頻度が高いgrade 3以上の有害事象は、下痢(13.8% vs. 0%)、食欲不振(6.9% vs. 0%)、疲労(3.4% vs. 0%)、腎機能低下(3.4% vs. 0%)であった。Grade 1-2の夜盲症がPimitespib群の13.8%の患者で観察された。有害事象に伴ってPimitespibの減量・休薬・治療中止が38.2%・67.2%・6.9%の患者で実施された。
表2 Adverse events in >10% of patients(発表者の許可を得て掲載)
まとめ
Imatinib・Sunitinib・Regorafenibに不応の進行性GISTに対して、Pimitespibはプラセボと比較してPFS・OSの延長および管理可能な有害事象プロファイルを示した。Pimitespibは、標準治療不能の進行性GISTを有する患者に対する本邦の新規標準治療となりうる。
(レポート:国立がん研究センター中央病院 消化管内科 平野 秀和)
References
1) Corless CL, et al.: Mod Pathol. 27(Suppl 1): S1-S16, 2014[PubMed]
2) Rubin BP, et al.: Lancet. 369(9574): 1731-1741, 2007[PubMed]
3) Garcia-Carbonero R, et al.: Lancet Oncol. 14(9): e358-e369, 2013[PubMed]
4) Doi T, et al.: Eur J Cancer. 121: 29-39, 2019[PubMed]
5) Korhonen P, et al.: J Biopharm Stat. 22(6): 1258-1271, 2012[PubMed]
関連サイト
・RIGHT試験[ClinicalTrials.gov]
加藤 健先生
国立がん研究センター中央病院 頭頸部・食道内科 科長