大腸癌の1次治療におけるTriplet(FOLFOXIRI)+抗EGFR抗体薬の意義を探索するための2つの無作為化第II相試験
#3501
The randomized phase II study of FOLFOXIRI plus cetuximab versus FOLFOXIRI plus bevacizumab as the first-line treatment in metastatic colorectal cancer with RAS wild-type tumors: The DEEPER trial (JACCRO CC-13)
Akihito Tsuji, et al.
#3502
Randomized study to investigate FOLFOXIRI plus either bevacizumab or cetuximab as first-line treatment of BRAF V600E-mutant mCRC: The phase-II FIRE-4.5 study (AIO KRK-0116)
Sebastian Stintzing, et al.
監修コメント
大腸癌の1次治療においてTriplet(FOLFOXIRI)+抗EGFR抗体薬は新しい標準レジメンとなるか?
RAS野生型大腸癌に対するTriplet+抗EGFR抗体薬併用療法のレジメンは、VOLFI試験で良好な奏効率が報告され、今後の新しいレジメンとなるか注目されていた1)。この試験では、BRAF変異型腫瘍や右側原発腫瘍にも良好な腫瘍縮小効果が認められており、RAS野生型大腸癌であれば、どのような腫瘍にも効果を認める“最強レジメン”として期待されていた。今回のASCO 2021では、RAS野生型に対するTriplet+Cetuximab併用療法の試験、BRAF変異型に対するTriplet+Cetuximab併用療法の試験が、なんとも良いタイミングで同時に発表され、Tripletレジメンの開発を行った筆者にとってはワクワクする内容となった。
結果は、RAS野生型に対しては左右問わず腫瘍縮小率が高いことが示され、一方で、BRAF変異型には奏効率のみならず無増悪生存期間がTriplet+Bevacizumab併用療法よりも良くないことが示された。ある意味、明暗が分かれた2試験の結果であった。BRAF変異型に対してTriplet+抗EGFR抗体薬が良くなかったのか、それともTriplet+Bevacizumabが良かったのか。FIRE-3試験のサブグループ解析では、BRAF変異型に対してFOLFIRI+Bevacizumab併用療法に対してFOLFIRI+Cetuximab併用療法が良好な腫瘍縮小を示していた2)。TripletレジメンにはOxaliplatinが含まれているが、BRAF変異型に対してはOxaliplatinと抗EGFR抗体薬の併用が良くないという妄想を抱いてしまう。今後のさらなる解析に注目したい。また、DEEPER試験ではDpRに両群で有意差を認めたものの、奏効率やR0切除率には有意差を認めなかった。Backboneの化学療法がTripletであり、奏効率やR0切除率は化学療法のパワーでプラトーに達しているのかもしれない。その点、DEEPER試験はプライマリーエンドポイントをDpRにしたことにより、抗EGFR抗体薬の“真の”効果を評価できたのかもしれない。DpRは生存期間と相関することが報告されている3)。今後、DEEPER試験の生存期間の解析結果が待ち遠しい。
(聖マリアンナ医科大学 臨床腫瘍学 教授 砂川 優)
RAS野生型進行大腸癌の1次治療における標準治療は、DoubletあるいはTriplet+Bevacizumab(Bev)とDoublet+抗EGFR抗体薬である。特にTriplet+BevはTRIBE試験において、Doublet+Bevと比較して高い奏効割合(ORR)と、良好な無増悪生存期間(PFS)および全生存期間(OS)が報告されている4)。また、抗EGFR抗体薬を併用したレジメンは、VOLFI試験やFIRE-3試験などの解析結果から、早期腫瘍縮小率(ETS: early tumor shrinkage)や最大腫瘍縮小率(DpR: depth of response)が高く、腫瘍縮小が期待できる治療である5,6)。これまでにTriplet+抗EGFR抗体薬とTriplet+Bevを前向きに比較した試験はない。今回報告されたAbstract #3501のDEEPER試験(JACCRO CC-13)は、未治療のRAS野生型大腸癌を対象にTriplet+Cetuximab(Cet)の有効性と安全性をTriplet+Bevと比較して検証することを目的とした無作為化第II相試験である。
また、RAS野生型においてBRAF V600E変異を有する大腸癌は非常に予後が不良であることが知られている7)。BRAF V600E変異型大腸癌においては、TRIBE試験のサブグループ解析で良好なOSが報告されていることから4)、Triplet(FOLFOXIRI)+Bevが標準治療の一つとされており、本邦のガイドラインでも「1次治療の方針を決定する際のプロセス」の中で同レジメンが提案されている。BRAF V600E変異型大腸癌に対する抗EGFR抗体薬の有効性についてはさまざまな議論がされているが、VOLFI試験ではBRAF V600E変異型のサブグループ解析においてFOLFOXIRI+PanitumumabのORRは86%と良好な結果が報告されており、抗EGFR抗体薬の併用の効果が期待されている1)。今回報告されたAbstract #3502のFIRE-4.5試験(AIO KRK-0116)は、未治療のBRAF V600E変異型大腸癌を対象にTriplet+Cetの有効性と安全性をTriplet+Bevと比較して検証することを目的とした無作為化第II相試験である。
これら2つの無作為化比較第II相試験について報告する。
mFOLFOXIRI+CetについてRAS野生型を対象にDpRを主要評価項目としたDEEPER試験、BRAF V600E変異型を対象にORRを主要評価項目としたFIRE-4.5試験
2つの試験はいずれもRAS野生型大腸癌の患者を対象としたが、FIRE-4.5試験はBRAF V600E変異を有する大腸癌の患者を対象とした。それ以外の適格基準については、いずれの試験も、ECOG PS(performance status)0-1(※DEEPER試験では71歳以上の場合PS 0)で、RECIST v1.1で測定可能病変を有し、転移性・再発病変に対して化学療法未施行の患者であった。
主要評価項目は、DEEPER試験はper-protocol populationにおけるDpRであり、FIRE-4.5試験ではRECIST v1.1に基づくORRであった。副次評価項目は、DEEPER試験では、8週時点でのETS、ORR、PFS、OS、R0切除率、忍容性であり、FIRE-4.5試験ではPFS、OS、忍容性であった。
対象患者は、mFOLFOXIRI+Cet(Cet群)とmFOLFOXIRI+Bev(Bev群)の2つの群に振り分けられ、DEEPER試験では1:1、FIRE-4.5試験では2:1の割合で分けられた。各薬剤の投与量は次のとおりであった。mFOLFOXIRI: 5-FU 2,400mg/m2+Leucovorin 200mg/m2+Irinotecan 150mg/m2+Oxaliplatin 85mg/m2(※FIRE-4.5試験では5-FUは3,000mg/m2、Leucovorinは400mg/m2)、Cet: 初回400mg/m2で導入し以降は毎週250mg/m2、Bev: 隔週で5mg/kg/body(※FIRE-4.5試験では7.5mg/kg/body)。
統計設定は、DEEPER試験では、Cet群のDpRの中央値がBev群と比較して12.5%上回ることを期待して、有意水準を0.05、検出力を85%とし、必要症例数を338例、登録予定数を360例とした。一方、FIRE-4.5試験では、Cet群のORRがBev群を37.5%上回ることを期待して、有意水準を0.10(片側)、検出力を80%とし、必要症例数を81例、登録予定数を108例とした。
RAS野生型の大腸癌においてmFOLFOXIRI+CetのDpRはmFOLFOXIRI+Bevを有意に上回った
DEEPER試験では2015年7月?2019年6月に359例の患者が登録された。登録患者の179例はCet群、180例はBev群に振り分けられ、per-protocol populationはそれぞれ158例と162例であった。患者背景は、いずれの群も年齢中央値が65歳であり、PS 0の割合はCet群とBev群それぞれ91.4%、90.8%、原発腫瘍の部位が左側の割合は82.3%、82.7%であった。投与サイクル数の中央値は、Cet群が10サイクル(範囲:1~65)、Bev群が12サイクル(範囲:1~51)であった。
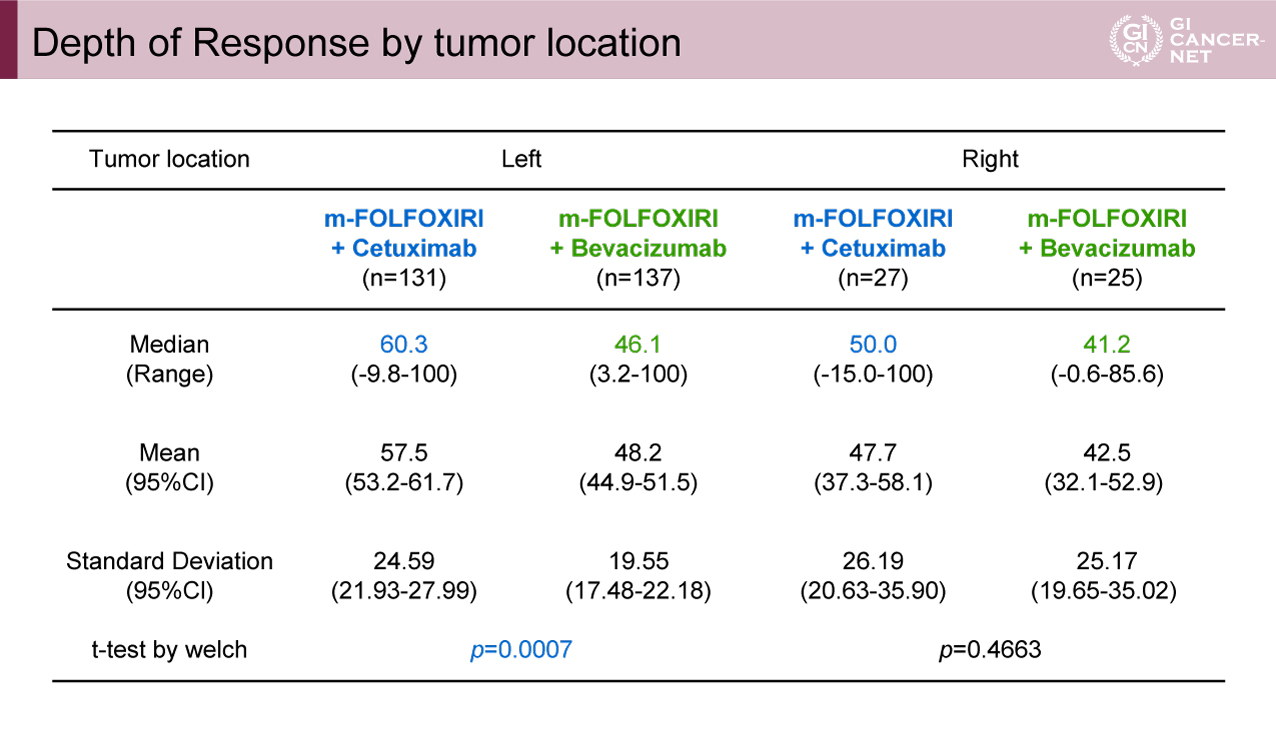
主要評価項目のDpRの中央値は、Cet群で57.4%(範囲:-15.0~100%)に対して、Bev群で46.0%(-0.6?100%)であり、Cet群が有意に高かった(p=0.0010)(図1)。原発腫瘍の部位別では、左側ではそれぞれ60.3% vs. 46.1%(p=0.0007)、右側では50.0% vs. 41.2%(p=0.4663)であり、左側で特にCet群のDpRが高い傾向が示された(表1)。
図1 Waterfall Plot (Depth of Response)(発表者の許可を得て掲載)(DEEPER試験より)
.jpg)
表1 Depth of Response by tumor location(発表者の許可を得て掲載)(DEEPER試験より)
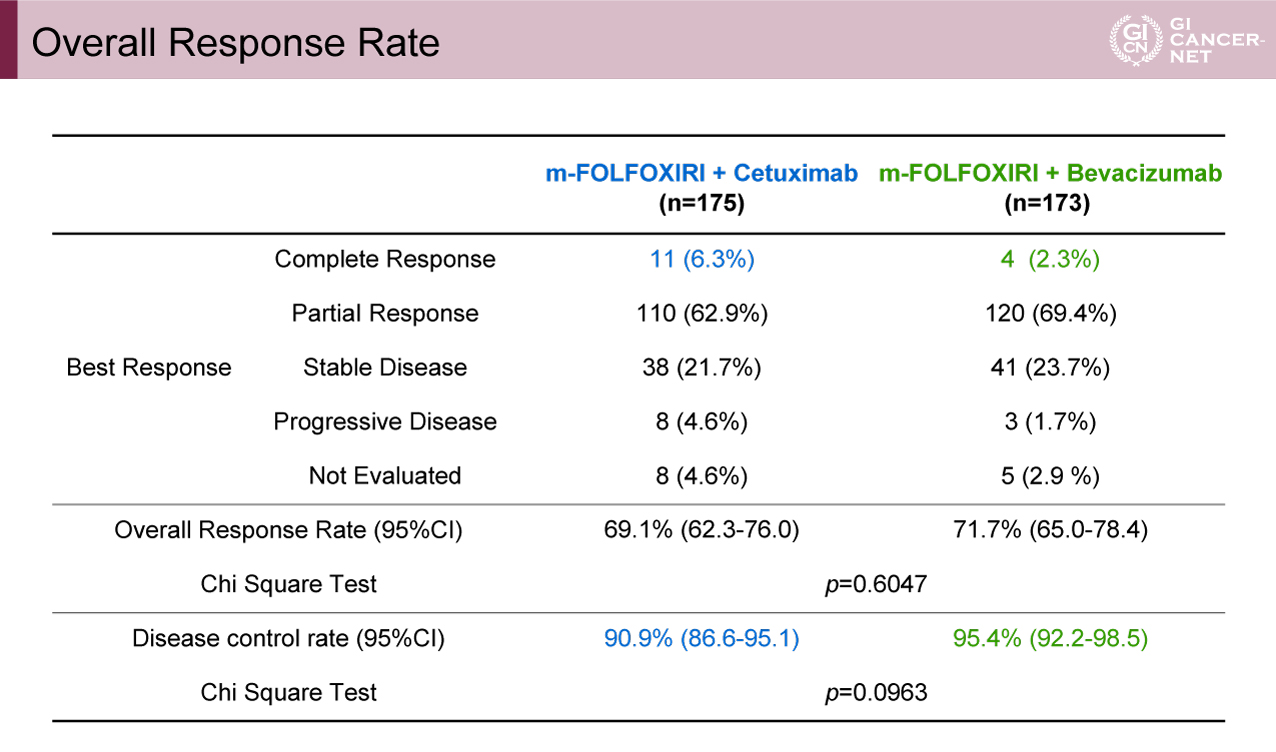
しかしながらORRはCet群が69.1%、Bev群が71.7%であり、有意な差はみられなかった(p=0.6047)(表2)。8週時点でのETSはそれぞれ77.8%、74.6%であり差はみられず(p=0.4792)、R0切除割合もそれぞれ28.6%、30.6%と差はみられなかった(p=0.6732)。
生存解析のデータは解析期間が不十分であったが、両群合わせたfull analysis setにおけるPFSとOSはそれぞれ12.7ヵ月(95% CI: 11.5-14.0)、37.6ヵ月(95% CI: 30.8-43.0)であった。
有害事象はASCO GI Symposium 2021でも既に報告されているが、Cet群では皮膚障害や爪囲炎、低マグネシウム血症が、Bev群では高血圧や出血が高い頻度でみられた8)。
表2 Overall Response Rate(発表者の許可を得て掲載)(DEEPER試験より)
BRAF V600E変異型の大腸癌においてmFOLFOXIRI+CetのORRはmFOLFOXIRI+Bevを上回らなかった
FIRE-4.5試験では、2016年11月?2020年12月にドイツの90施設とフランスの10施設、オーストリアの3施設で109例の患者が登録され、Cet群73例とBev群36例に無作為に振り分けられた。
患者背景では、年齢中央値はCet群とBev群それぞれ62歳、64歳であり、PS 0の割合は61.1%、65.7%、原発部位が左側の割合は48.6%、45.7%であった。
有害事象では、Cet群では皮膚障害や爪囲炎、低マグネシウム血症が、Bev群では穿孔が高い頻度でみられたが、予期される範囲のものであった。
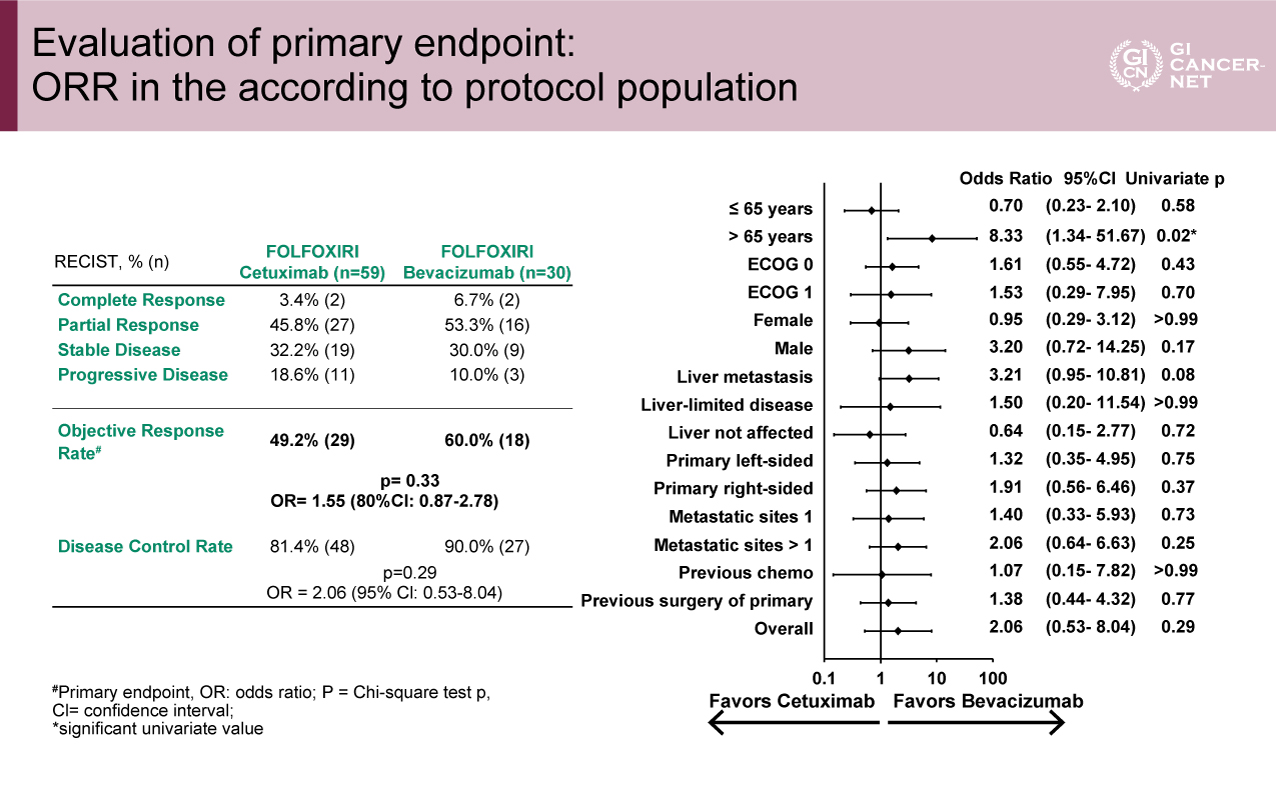
主要評価項目のORRは、Cet群で49.2%、Bev群で60.0%あり(OR=1.55、80% CI: 0.87-2.78、p=0.33)、Cet群の有意差は証明されなかった(図2)。サブグループ解析においてもCet群が有意な患者群はみられなかった。
図2 Evaluation of primary endpoint: ORR in the according to protocol population
(発表者の許可を得て掲載)(FIRE-4.5試験より)
PFSの中央値は、Cet群が6.3ヵ月、Bev群が10.1ヵ月とBev群のほうが良好であった(HR=2.03、p=0.01)(図3)。また、解析期間は不十分ではあるが、OSの中央値は、それぞれ15.2ヵ月と17.1ヵ月であり、有意な差はみられなかった(HR=1.35、p=0.46)(図4)。
図3 Progression-Free-Survival (PFS)(発表者の許可を得て掲載)(FIRE-4.5試験より)
.jpg)
図4 Overall Survival (OS)(発表者の許可を得て掲載)(FIRE-4.5試験より)
.jpg)
DEEPER試験およびFIRE-4.5試験のまとめ
DEEPER試験では、RAS野生型大腸癌の1次治療においてmFOLFOXIRI+CetがmFOLFOXIRI+Bevと比較してDpRが有意に高いことが示された。しかしながらETSやORR、R0切除率においては、両レジメン間で有意な差はみられなかった。
FIRE-4.5試験では、BRAF V600E変異型大腸癌の1次治療においてmFOLFOXIRI+CetがmFOLFOXIRI+Bevと比較してORRが高くないことが示された。また、PFSにおいてはmFOLFOXIRI+Bevのほうが良好な結果であった。
(レポート:聖マリアンナ医科大学 臨床腫瘍学 武田 弘幸)
References
1) Modest DP, et al.: J Clin Oncol. 37(35): 3401-3411, 2019[PubMed]
2) Stintzing S, et al.: Eur J Cancer. 79: 50-60, 2017[PubMed]
3) Froelich MF, et al.: Clin Colorectal Cancer. 19(4): 291-300.e5, 2020[PubMed]
4) Cremolini C, et al.: Lancet Oncol. 16(13): 1306-1315, 2015[PubMed]
5) Kurreck A, et al.: J Cancer Res Clin Oncol. 146(10): 2681-2691, 2020[PubMed]
6) Stintzing S, et al.: Lancet Oncol. 17(10): 1426-1434, 2016[PubMed]
7) Modest DP, et al.: Ann Oncol. 27(9): 1746-1753, 2016[PubMed]
8) Watanabe T, et al.: J Clin Oncol. 39(3_suppl): 86-86, 2021[JCO]
関連サイト
・DEEPER試験[ClinicalTrials.gov]
・FIRE-4.5試験[ClinicalTrials.gov]
・VOLFI試験[学会レポート(ESMO 2018)][学会レポート(ESMO 2017)][ClinicalTrials.gov]
・FIRE-3試験[ClinicalTrials.gov]
・TRIBE試験[論文紹介(2018)][論文紹介(2015)][学会レポート][ClinicalTrials.gov]
砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学 教授