16週間の1次治療後に安定または奏効した切除不能大腸癌患者に対するCapecitabineによる維持療法とアクティブモニタリングの無作為化比較試験(FOCUS4-N試験)
Oral maintenance capecitabine versus active monitoring for patients with metastatic colorectal cancer (mCRC) who are stable or responding after 16 weeks of first-line treatment: Results from the randomized FOCUS4-N trial
Richard Adams, et al.
監修コメント
COVID-19パンデミックによるロックダウンを実施する英国から、旬の演題が発表された。本試験は、切除不能大腸癌に対し導入療法を実施した後の維持療法としての、Capecitabine単剤療法の有用性を経過観察と比較して評価している。PFS延長を認め、QOL評価でも有意差を認めなかったことから、Capecitabine単剤維持治療は有用と結論付けている。一方、両群でOSが同程度であった点を踏まえると、治療を中断する選択肢も実地診療では許容されるだろう。治療中断のメリットは、治療による時間的拘束や副作用からの解放、経済的負担の軽減が考えられる。本邦ではCapecitabine+Bevacizumabを用いた維持療法が実施されることが一般的であるが、静注投与と医療機関受診を減らすCapecitabine療法や治療中断を余儀なくされる可能性もあり、その際には本試験の結果が役に立つだろう。本試験ではサブグループ解析で維持療法のメリットが大きい対象として、左側原発や遺伝変異の有無がいくつか挙げられていたが、今後、維持治療の必要な患者の適切な選択が行えれば、治療中断の恩恵をより広げられるかもしれない。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
導入療法で病勢コントロールされた患者に対する維持療法の検討
切除不能大腸癌における維持療法や治療中断は、AIO-0207試験1)やCAIRO3試験2)など、これまでいくつかのエビデンスが示されている。CAIRO3試験では、Capecitabine+Bevacizumab併用療法によりPFSは延長するがOSは延長しないことが示されており、治療中断はOSを損なうことなく毒性を低減する可能性が示されている。FOCUS4-Nでは、導入療法で病勢コントロールされた患者を対象に、Capecitabine単剤による維持療法が検討された。
無増悪生存期間(PFS)を主要評価項目とし、Capecitabine単剤維持療法とアクティブモニタリングを比較
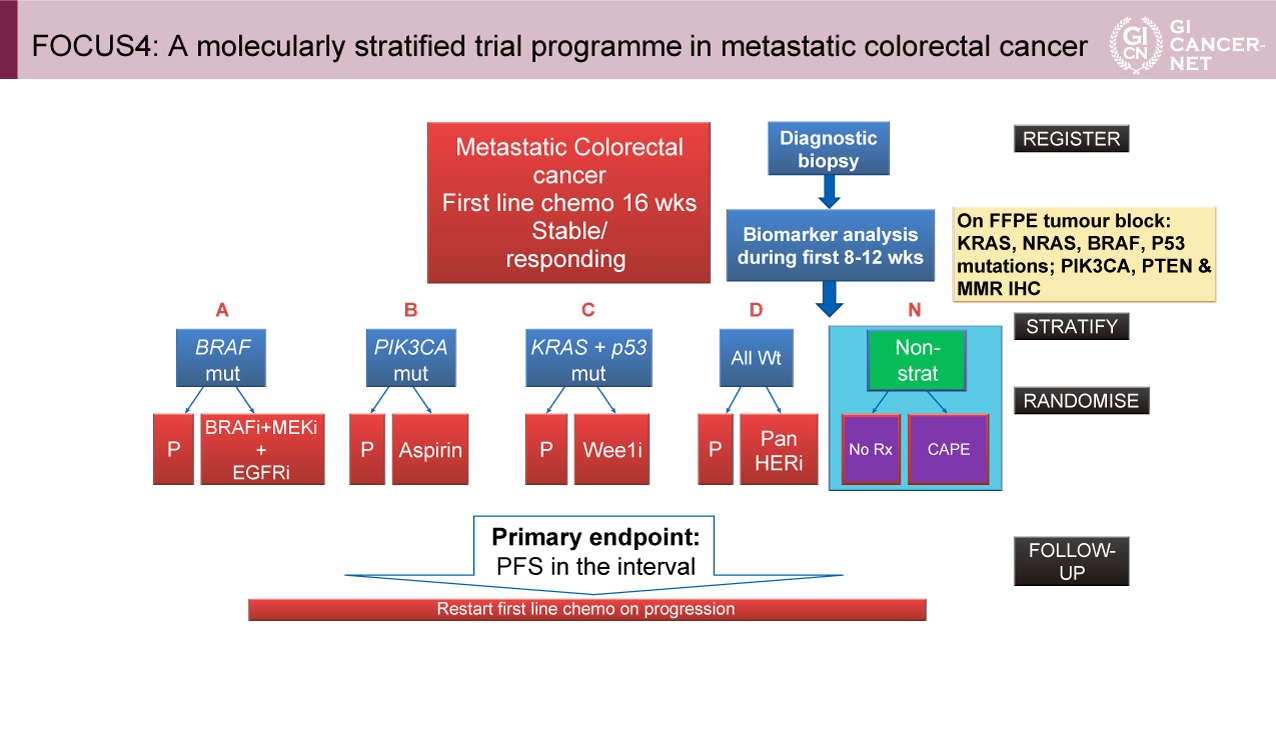
FOCUS4は、英国の88の病院で新たに切除不能大腸癌と診断された患者が登録されるアンブレラ試験であり、16週間の導入療法を受けた患者を分子サブタイプごとに分類し、各サブトライアルに登録された(図1)。MSI、BRAF、PIK3CA、TP53、RAS変異陽性例もしくは全て野生型の症例では標的治療のサブトライアルが提案され、標的療法のサブトライアルが利用できない、もしくは参加しなかった患者にはFOCUS4-N試験への参加が提案された。
登録患者は、Capecitabine療法(Capecitabine 1,250mg/m2、14日間内服、21日サイクル)またはアクティブモニタリングに1:1で無作為に割り付けられた。主要評価項目はPFSとし、無作為化された日を起算日としてRECIST v1.1に基づく病勢進行もしくはあらゆる原因による死亡までと定義した。副次評価項目はOS、毒性、QOLとした。病勢進行を認めた場合、患者は最初の治療を再開した。
図1 FOCUS4: A molecularly stratified trial programme in metastatic colorectal cancer
(発表者の許可を得て掲載)
Capecitabine単剤維持療法はPFSを有意に延長したが、OSの延長は認められなかった
2014年3月から2020年3月にかけて、全体で1,434例の患者が登録され、16週時点の評価でCR/PR/SDであった症例は924例であった(図2)。患者組み入れはCOVID-19により英国がロックダウンされた2020年3月で停止され、7月に終了した。FOCUS4-N試験は254例の患者が無作為化割り付けされた。患者背景は各群間でバランスが取れていたが、イベント発生率はアクティブモニタリング群でやや高く、COVID-19パンデミックにより募集が停止したため最終解析は早期に開始された。
PFS中央値はアクティブモニタリング群1.87ヵ月、Capecitabine群3.84ヵ月、調整ハザード比(HR)=0.38(95% CI: 0.28-0.51)、p<0.0001であった。PFSで3分割した場合、PFSの短い集団では両群のPFSに違いはなく、中間およびPFSの長い集団ではCapecitabine群で明らかにPFSが伸びていた(図3)。OS中央値はアクティブモニタリング群15.2ヵ月、Capecitabine群14.8ヵ月、調整HR=0.93(95% CI: 0.69-1.27)、p=0.66で差を認めなかった(図4)。
有害事象はgrade 2以上の疲労(12% vs. 25%)、下痢(13% vs. 23%)、手足症候群(3% vs. 26%)がCapecitabine群で多かった。QOLは、両群間に有意差は認められなかった。
図2 FOCUS4-N: Consort diagram(発表者の許可を得て掲載)
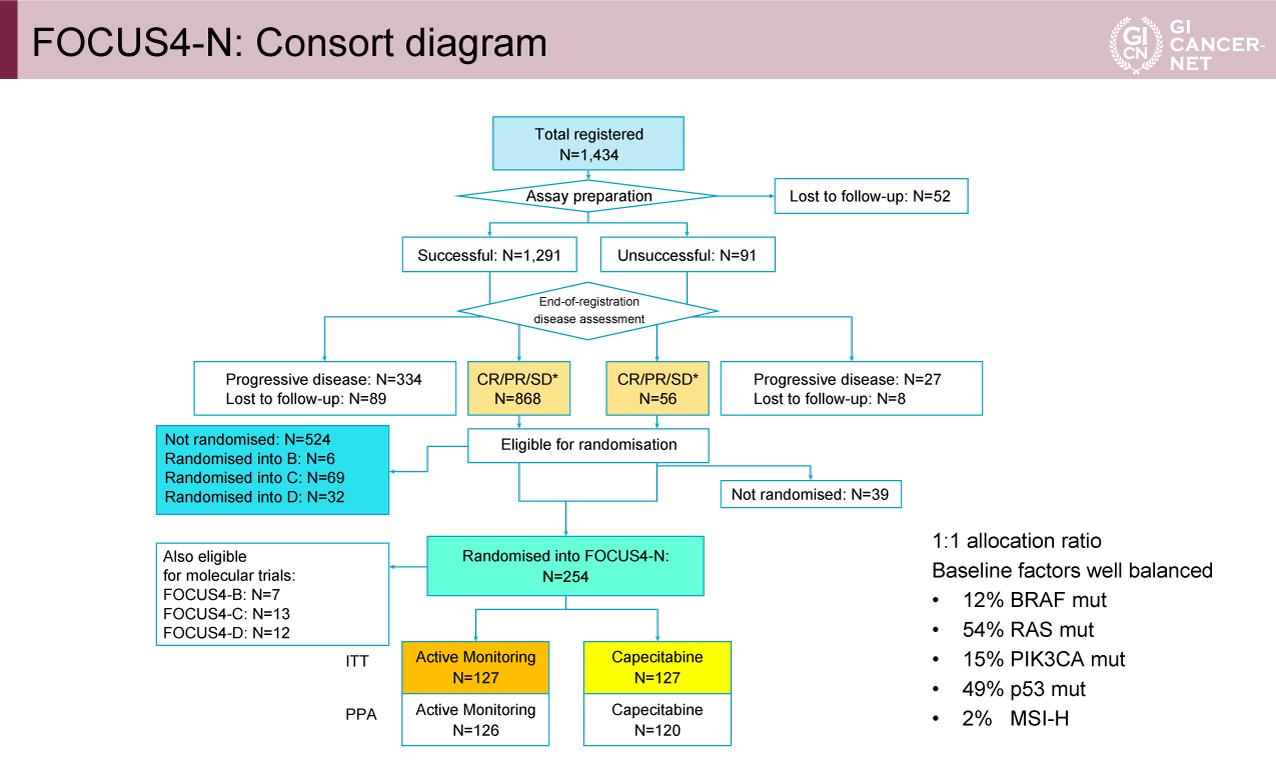
図3 FOCUS4-N: Swimmer Plot(発表者の許可を得て掲載)
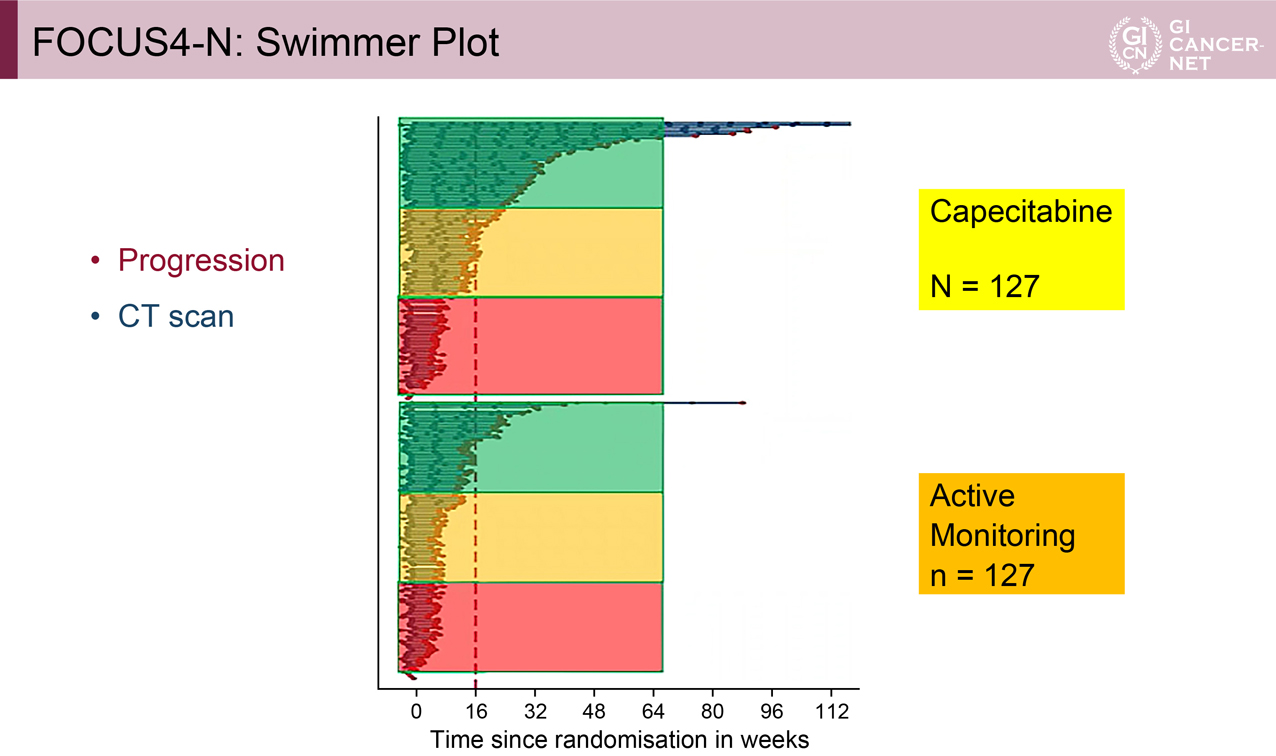
図4 FOCUS4 N: Overall Survival (ITT)(発表者の許可を得て掲載)
--.jpg)
まとめ
Capecitabine単剤による維持療法は、切除不能大腸癌の導入療法で安定もしくは奏効を示した患者に対する有効な治療であることが示された。
(レポート:愛知県がんセンター 薬物療法部 中澤 泰子)
References
1) Hegewisch-Becker S, et al.: Lancet Oncol. 16(13): 1355-1369, 2015[PubMed]
2) Simkens LHJ, et al.: Lancet. 385(9980): 1843-1852, 2015[PubMed]
関連サイト
・FOCUS4試験[FOCUS4]
・FOCUS4-N試験[Protocol]
・AIO-0207試験[ClinicalTrials.gov]
・CAIRO3試験[ClinicalTrials.gov]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長