ctDNAでの分子選択に基づく切除不能大腸癌患者に対する抗EGFR抗体薬リチャレンジ療法の第II相試験(CHRONOS試験)
Phase II study of anti-EGFR rechallenge therapy with panitumumab driven by circulating tumor DNA molecular selection in metastatic colorectal cancer: The CHRONOS trial
Andrea Sartore-Bianchi, et al.
監修コメント
切除不能大腸癌に対する後方治療はRegorafenibやFTD/TPIが標準治療であるものの、その効果は限定的である。RAS野生型大腸癌に対する抗EGFR抗体薬は、有効性を示しその後不応となった後に一定の空白期間をおいて再投与するリチャレンジ療法が期待されている。どのような治療にもリチャレンジの概念は存在するが、抗EGFR抗体薬は腫瘍選択性が高いこと、耐性クローンとしての獲得性RAS変異の存在や、投与を中断するとその耐性クローンが減衰していくことが報告されており、適切な患者選択へのリキッドバイオプシーの活用も期待されている。本報告は、リチャレンジ直前のctDNAステータスによって患者を選択した上で抗EGFR抗体薬のリチャレンジを行う初めての介入試験であった。
本試験の評価は悩ましい。ORRは30%であったが、confirmed responseに限ると22%であり、これはリキッドバイオプシーによる患者選択を行わなかったCRICKET試験の奏効割合と変わらない。PFS中央値はCRICKET試験の3.4ヵ月よりも長い傾向にあったが、本試験は前治療レジメン数が多く、期待できる予後が長い患者が比較的多く選択されて登録された可能性もある。リキッドバイオプシーで検査された遺伝子異常についても、RAS変異はエクソン4が含まれておらず、EGFR ECD変異も4ヵ所だけであったことから、十分に患者選択が行えていたか課題が残る。また、抗EGFR抗体薬空白期間とリチャレンジの有効性に差はなかった、という結果であったが、全体として空白期間の長い患者(ほとんどが4ヵ月以上)が登録されている点は結果の解釈を悩ましくしている。ただ、殺細胞性抗がん薬を併用しないPanitumumab単剤療法であったことから、純粋に抗EGFR抗体薬リチャレンジの有効性が観察できた点は評価できる。
既報と合わせて考えると、抗EGFR抗体薬リチャレンジ療法は第III相試験で有用性を示したエビデンスはないため、ガイドラインに掲載されるような標準治療とは言い難い。しかし、予後や治療選択肢の限られた後方ラインの患者において、抗EGFR抗体薬インターバルや、OncoBEAM™ RAS CRCキットによるリキッドバイオプシーの遺伝子型を参考に本治療を試みることは現実的にはあり得る。さらなるエビデンスの創出が待ち遠しい。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
切除不能大腸癌の後方ライン治療戦略
切除不能大腸癌患者に対する後方ライン治療としてのRegorafenibやTAS-102療法は、治療効果は限定的である1,2)。新たな治療として、抗EGFR抗体薬を使用し有効であった後に不応となった患者に対して抗EGFR抗体薬を再投与する試み(リチャレンジ)が行われてきた。抗EGFR抗体薬耐性にRASやEGFR細胞外ドメイン(ECD)の獲得変異の関与が報告され3,4)、抗EGFR抗体薬中止後に腫瘍が再度感受性を取り戻すことが示唆されている5,6)。
抗EGFR抗体薬リチャレンジ療法に関する第II相試験であるCRICKET試験7)では全集団での全奏効割合(ORR)21.4%、リチャレンジ前に行われたctDNA検査でRAS野生型症例では30.8%であった。
本試験はctDNAモニタリングを行いながらその分子選択に基づいて抗EGFR抗体薬Panitumumab療法リチャレンジの有効性を探索する第II相試験である。
抗EGFR抗体既治療例に対するPanitumumabのリチャレンジ
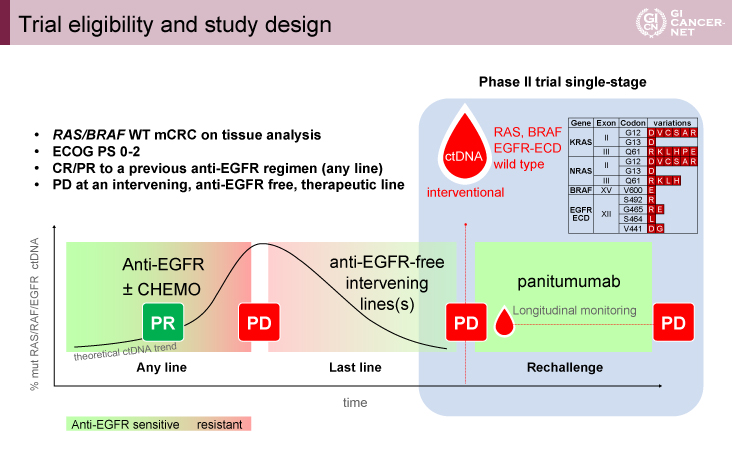
主な適格基準は①RAS/BRAF野生型の切除不能大腸癌と組織学的に診断されている、②抗EGFR抗体薬を含む前治療でPR(Partial Response)以上の治療効果が認められた、③抗EGFR抗体リチャレンジ前にctDNAにてRAS/BRAF/EGFR野生型と診断された、④ECOG PS(Eastern Cooperative Oncology Group Performance Status)≦2、であった。
治療ラインを問わず抗EGFR抗体を含んだ治療にPR以上となりPD(Progressive Disease)後に、抗EGFR抗体薬を含まない治療が行われPDとなった症例に対してリキッドバイオプシーによるctDNA検査が行われた。RAS/BRAF/EGFR野生型と診断された症例に対してPanitumumab単剤療法(6mg/kg、2週間毎)がPDまで行われた(図1)。
主要評価項目はORR、副次評価項目は無増悪生存期間(PFS)、全生存期間(OS)、有害事象であった。ORRの閾値10%、期待値30%、power=85%、type I error=0.05から目標症例数は27例となった。
図1 Trial eligibility and study design(発表者の許可を得て掲載)
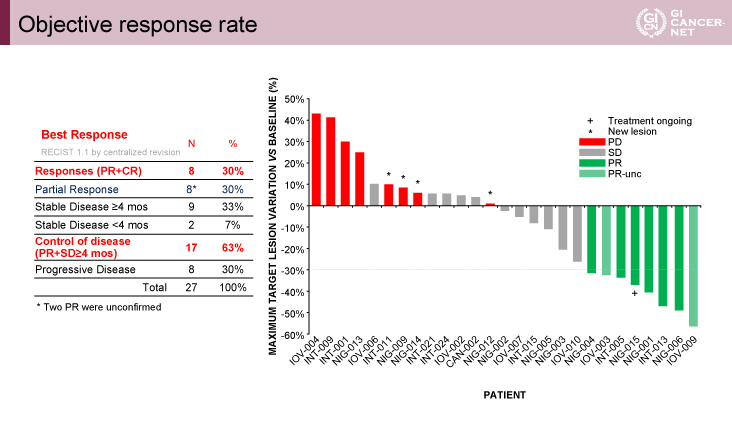
主要評価項目を達成:ORR 30%
2019年8月19日から2020年11月6日までに52例にctDNA検査が行われ、36例(69%)がRAS/BRAF/EGFR野生型と判定された。うち27例が本試験に登録された。
患者背景は、年齢中央値64歳、前治療ライン数中央値3、前治療で使用された抗EGFR抗体薬はPanitumumab、Cetuximab、両剤でそれぞれ55%、41%、4%であった。また原発巣の腫瘍占拠部位は右側、左側、直腸でそれぞれ15%、66%、19%であった(図2)。
主要評価項目であるORRは30%であり主要評価項目を達成した(図3)。副次評価項目であるPFS中央値は16.4週であった。また、前治療の抗EGFR抗体薬最終投与からの期間、前治療レジメン数、原発巣占居部位と治療効果の間には明らかな相関はなかった。
図2 Baseline characteristics(発表者の許可を得て掲載)
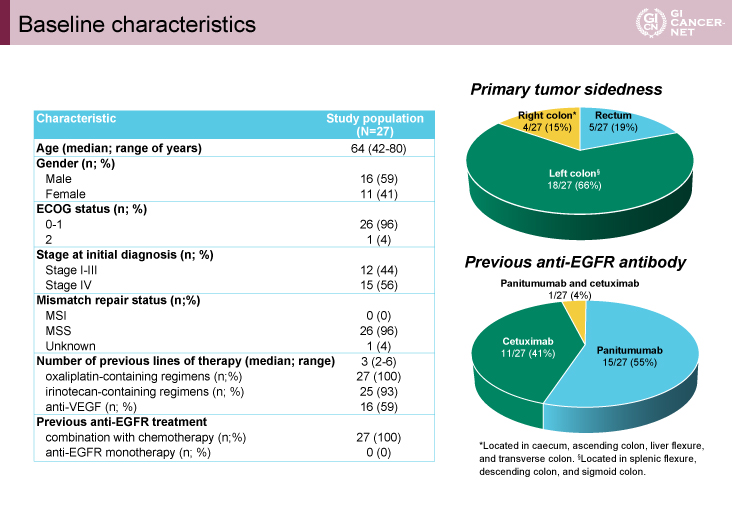
図3 Objective response rate(発表者の許可を得て掲載)
まとめ
本試験は、リキッドバイオプシーの結果をもとに選択された患者に対するPanitumumab療法のリチャレンジ試験として最初のものであり、30%の奏効が得られた。抗EGFR抗体薬のインターバルや前治療歴によらず患者選択が可能であり、効果がないと想定される約30%の患者への治療を避け、高い効果が得られた。現在日常臨床で使用されている後方ラインでの標準治療と比較して高い治療効果を得られる可能性があることが示唆された。
(レポート:愛知県がんセンター 薬物療法部 熊西 亮介)
References
1) Grothey A, et al.: Lancet. 381(9863): 303-312, 2013[PubMed]
2) Mayer RJ, et al.: N Engl J Med. 372(20): 1909-1919, 2015[PubMed]
3) Misale S, et al.: Nature. 486(7404): 532-536, 2012[PubMed]
4) Diaz Jr LA, et al.: Nature. 486(7404): 537-540, 2012[PubMed]
5) Siravegna G, et al.: Nat Med. 21(7): 795-801, 2015[PubMed]
6) Parseghian CM, et al.: Ann Oncol. 30(2): 243-249, 2019[PubMed]
7) Cremolini C, et al.: JAMA Oncol. 5(3): 343-350, 2019[PubMed]
関連サイト
・CRICKET試験[論文紹介][ClinicalTrials.gov]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長