GEM+CDDP併用療法の治療歴がある転移性胆道癌に対するnal-IRI+5-FU/LV併用療法vs. 5-FU/LV療法の多施設共同無作為化第IIb相試験(NIFTY試験)
Liposomal irinotecan (nal-IRI) in combination with fluorouracil (5-FU) and leucovorin (LV) for patients with metastatic biliary tract cancer (BTC) after progression on gemcitabine plus cisplatin (GemCis): Multicenter comparative randomized phase 2b study (NIFTY)
Changhoon Yoo, et al.
監修コメント
本試験ではGEM+CDDP併用療法不応の転移を伴う胆道癌患者を対象とし、5-FU/LVに対するnal-IRIの上乗せ効果を検討した無作為化第II相試験である。主要評価項目に設定された無増悪生存(PFS)期間の有意な延長効果が認められた。また、副次評価項目に設定された全生存(OS)期間もハザード比0.68(95%信頼区間0.48-0.98)と有意に延長していた。
胆道癌に対する2次薬物療法として、近年はFGFR2、IDH1/2、BRCA1/2、HER2、RAS-MAPK経路、BRAF、NTRKの遺伝子変異に基づく治療選択を行うことが試みられている1)。本邦でもFGFR融合遺伝子陽性の治癒切除不能な胆道癌に対してPemigatinibが承認され、遺伝子パネル検査が浸透しつつある。
一方、特定の遺伝子変異が検出されない患者も多く、オールカマーを対象とした治療開発としてmodified FOLFOX療法の有用性がASCO 2019で示された。さらに、無作為化第II相試験であるものの、本試験の結果、nal-IRI+5-FU/LVの有用性が示されたことから、1次薬物療法としてGEM+CDDP併用療法が選択された患者では、5-FU/LVベースの併用療法が主流になるものと考えられる。本邦では先進医療としてFOLFIRINOXの第II相試験が実施中(jRCTs031180082)であり、今後の展開が期待される。
(金沢大学先進予防医学研究センター 特任准教授 寺島 健志)
切除不能進行胆道癌に対する2次治療
切除不能進行胆道癌に対する1次化学療法は英国で行われた無作為化第III相試験(ABC-02試験)の結果、Gemcitabine(GEM)+Cisplatin(CDDP)併用療法が標準治療として広く行われている2)。その後の2次化学療法に関しては、ASCO 2019でFOLFOX療法の支持緩和療法との無作為化第III相試験(ABC-06試験)の結果、同療法の全生存期間における優越性が報告され、2次化学療法における新たな標準治療の一つとみなされている3)。
近年、がんゲノムプロファイリング検査が臨床実装され、バイオマーカーに基づく治療戦略も試みられている。胆道癌においては、主に肝内胆管癌の約20%で検出されるFGFR2融合遺伝子やIDH-1遺伝子変異症例に対してはそれぞれFGFR阻害薬(Pemigatinib)、IDH阻害薬(Ivosidenib)の有効性が報告され4,5)、Pemigatinibに関しては米国食品医薬品局(FDA)で迅速承認され、本邦においても「がん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道癌」に対し、2021年3月に製造販売承認された。
一方、バイオマーカーによらない2次化学療法の候補として、胆道癌に組織発生学的に類似した切除不能膵癌においては2次治療におけるナノリポソーム型イリノテカン(nal-IRI)と5-FU/LVの併用療法(nal-IRI+5-FU/LV併用療法)が標準治療として確立されている6)。今回、転移性胆道癌の2次化学療法における同療法の有用性を検証する目的で本多施設共同無作為化第IIb相試験(NIFTY試験)が実施された(なお、本試験は前述のABC-06試験より前に開始された)。
2次治療におけるnal-IRI+5-FU/LV併用療法と5-FU/LV療法の無作為化第IIb相試験
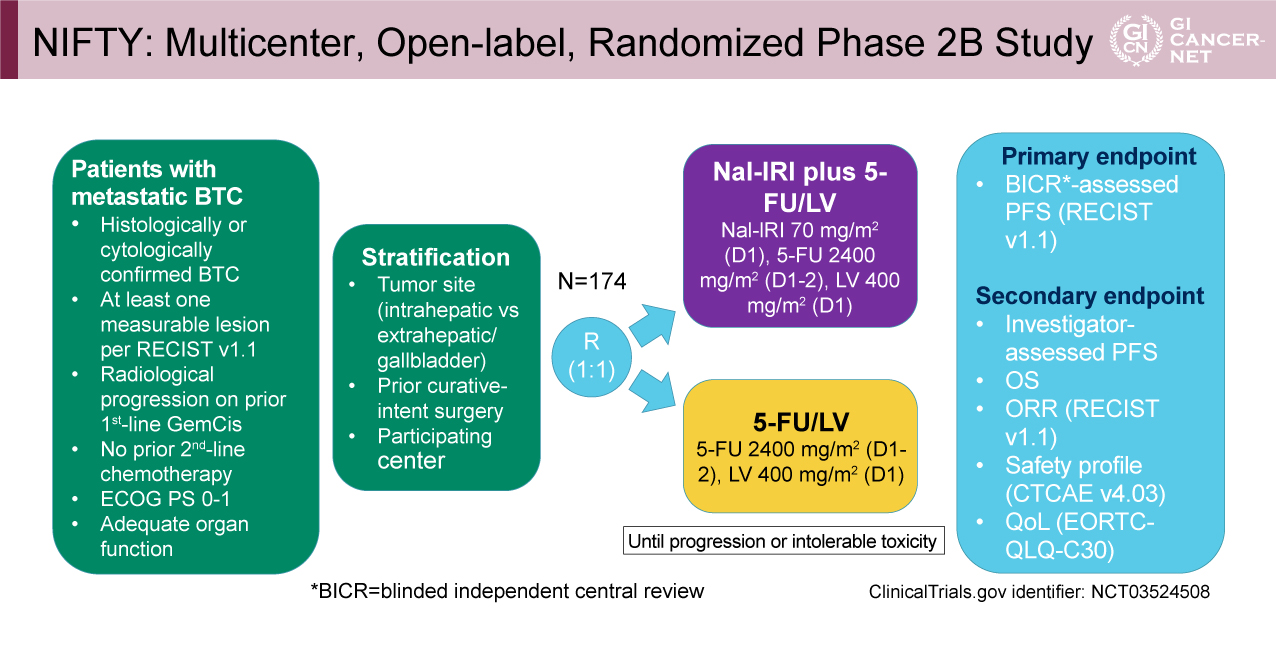
本試験の主な適格基準は、(1)病理組織学的に診断された転移性胆道癌、(2)測定可能病変あり、(3)1次化学療法として施行したGEM+CDDP併用療法に不応、(4)2次化学療法未施行、(5)ECOG PS 0-1、(6)十分な臓器機能を有していること、であった。登録患者をnal-IRI+5-FU/LV併用療法(nal-IRI 70mg/m2 day 1、5-FU 2,400mg/m2 day 1-2、LV 400mg/m2 day 1、q2wks)群と5-FU/LV療法群(5-FU 2,400mg/m2 day 1-2、LV 400mg/m2 day 1、q2wks)に1:1に割り付けた。層別化因子として部位(肝内胆管vs.肝外胆管/胆?)、外科切除の有無、登録施設が設定された。
主要評価項目は盲検下独立中央判定による無増悪生存期間(BICR-assessed PFS)、副次評価項目は主治医判定による無増悪生存期間(investigator-assessed PFS)、全生存期間(OS)、奏効割合(ORR)(RECIST v1.1)、安全性(CTCAE v4.03)、Quality of Life(QOL)(EORTC-QLQ-C30)であった(図1)。本試験はnal-IRIの上乗せによるハザード比(HR)を0.6(nal-IRI+5-FU/LV併用療法のPFS中央値を3.3ヵ月、5-FU/LV併用療法のPFS中央値を2.0ヵ月)と仮定し、有意水準両側5%、検出率80%と設定し、10%の脱落を見込み、必要症例数は174例と算出された。
図1 NIFTY: Multicenter, Open-label, Randomized Phase 2B Study(発表者の許可を得て掲載)
Nal-IRI+5-FU/LV併用療法は5-FU/LV療法に対して生存期間における優越性を示した
本研究は韓国の5施設で実施された医師主導臨床研究であり、2018年9月から2020年2月までの間に178例が登録され、nal-IRI+5-FU/LV併用療法群に88例、5-FU/LV療法群に90例が割り付けられた。患者背景に有意な群間差は認められなかった。
主要評価項目のBICR-assessed PFSに関してはHR=0.56(95%信頼区間[CI]: 0.39-0.81、p=0.0019)、PFS中央値7.1ヵ月vs. 1.4ヵ月、6ヵ月PFS割合55.7% vs. 26.2%とnal-IRI+5-FU/LV併用療法群で有意な延長効果が認められた(図2)。副次評価項目のinvestigator-assessed PFSに関しては、HR=0.48(95% CI: 0.34-0.69、p<0.0001)、PFS中央値3.9ヵ月vs. 1.6ヵ月、6ヵ月PFS割合30.6% vs. 11.6%とnal-IRI+5-FU/LV併用療法群で有意な延長効果が認められ、OSに関してもHR=0.68(95% CI: 0.48-0.98、p=0.0349)、OS中央値8.6ヵ月vs. 5.5ヵ月、6ヵ月OS割合60.7% vs. 45.9%、1年OS割合35.4% vs. 22.4%とnal-IRI+5-FU/LV併用療法群で有意な延長効果が認められた。BICR-assessed PFS、investigator-assessed PFS、OSに関してはいずれのサブグループにおいてもnal-IRI+5-FU/LV併用療法群で良好な傾向を示した(図3)。またORRに関してはBICR-assessed ORRが14.8% vs. 5.8%(p=0.0684)、investigator-assessed ORRが19.3% vs. 2.3%(p=0.0002)でnal-IRI+5-FU/LV併用療法で高い傾向にあった。
一方、有害事象に関してはgrade 3以上がNal-IRI+5-FU/LV併用療法群に77.3%、5-FU/LV療法群に33.7%、特に好中球数減少(23.9% vs. 1.2%)、疲労(12.5% vs. 3.5%)がnal-IRI+5-FU/LV併用療法群に多く認められたが、いずれも許容範囲内のものであった。なおQOLに関しては両群ともに差は認められなかった。
図2 Primary Endpoint: BICR-Assessed PFS(発表者の許可を得て掲載)
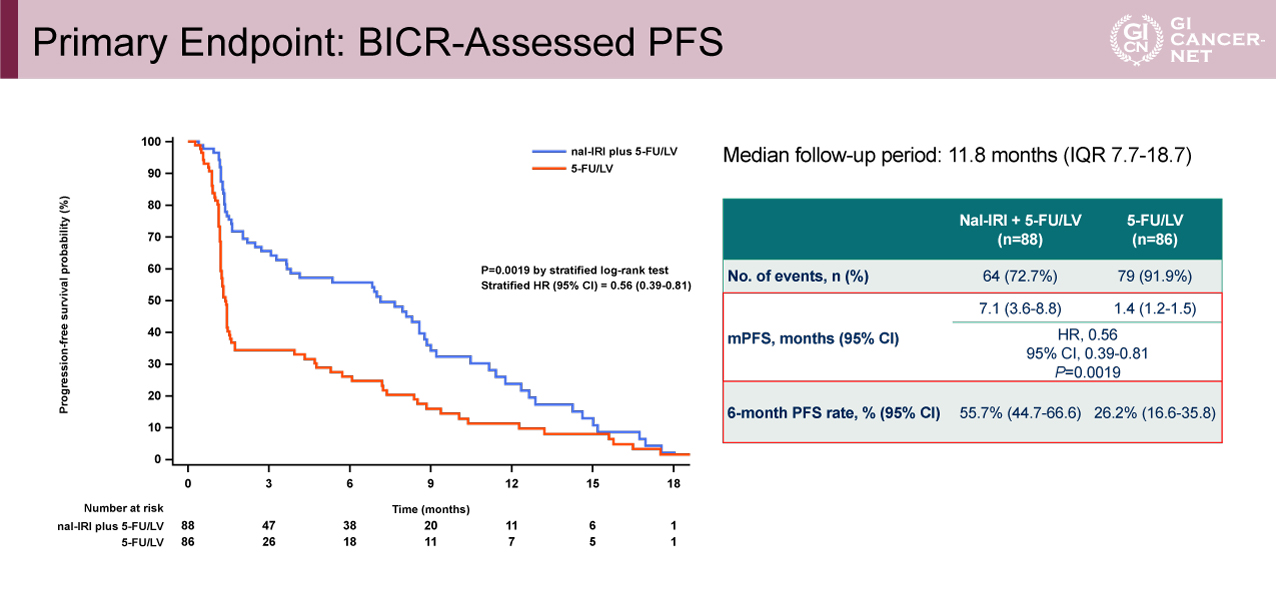
図3 Subgroup Analysis for PFS and OS(発表者の許可を得て掲載)

まとめ
GEM+CDDP併用療法に不応後の転移性胆道癌に対する2次治療としてのnal-IRI+5-FU/LV併用療法は、5-FU/LV療法に対し、生存期間における有意な延長効果を示した。
Nal-IRI+5-FU/LV併用療法は転移性胆道癌の2次治療における新たな標準治療の一つになりうると考えられた。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
1) Tella SH, et al. Lancet Oncol. 21(1): e29-e41, 2020[PubMed]
2) Valle J, et al.: N Engl J Med. 362(14): 1273-1281, 2010 [PubMed]
3) Lamarca A, et al.: Lancet Oncol. 22(5): 690-701, 2021[PubMed]
4) Abou-Alfa GK, et al.: Lancet Oncol. 21(5): 671-684, 2020[PubMed]
5) Abou-Alfa GK, et al.: Lancet Oncol. 21(6): 796-807, 2020[PubMed]
6) Wang-Gillam A, et al.: Lancet. 387(10018): 545-557, 2016[PubMed]
関連サイト
・NIFTY試験[ClinicalTrials.gov]
・ABC-02試験[ClinicalTrials.gov]
・ABC-06試験[学会レポート][ClinicalTrials.gov]
寺島 健志先生
金沢大学先進予防医学研究センター 特任准教授