切除不能進行肝細胞癌に対するFOLFOX肝動注療法vs. Sorafenib単剤療法の無作為化第III相試験(FOHAIC-1試験)
Hepatic arterial infusion chemotherapy of oxaliplatin plus fluorouracil versus sorafenib in advanced hepatocellular carcinoma: A biomolecular exploratory, randomized, phase 3 trial (The FOHAIC-1 study)
Ming Zhao, et al.
監修コメント
進行肝細胞癌患者を対象とし、Sorafenib単剤療法に対するFOLFOX肝動注化学療法の優越性を検証した第III相試験である。主要評価項目に設定された全生存(OS)期間、副次評価項目に設定された無増悪生存(PFS)期間、奏効割合いずれもFOLFOX肝動注化学療法が良好な結果であった。
進行肝細胞癌に対する1次薬物療法としては長らく、Sorafenibが標準治療とされてきたが、REFLECT試験においてLenvatinibのSorafenibに対する非劣性が検証され優越性は検証されなかった。また、IMbrave150試験においてAtezolizumab+Bevacizumab併用療法のSorafenibに対する優越性が検証され、本邦でも2020年9月より使用可能となった。一方、肝動注化学療法はSorafenibの登場以前より本邦を中心にその有効性が言われてきたものの大規模な無作為化比較試験が行われずエビデンスとして確立されてこなかった。また、2005年にはCisplatinの動注用製剤であるアイエーコール®が承認されたが、至適なレジメンは確立しておらず、アイエーコール®肝動注や5-FU+Cisplatin併用肝動注が本邦では実施されている。
今回、FOLFOX肝動注化学療法が試験計画当時の標準治療であるSorafenibに対して優越性が検証されたことは、上記のような本邦の状況を鑑みても極めて意義深い。本試験がAtezolizumab+Bevacizumab併用療法の有用性が検証されたIMbrave150試験と異なる点として、本試験は中国で実施されたことから、成因がHBVであった患者が大半を占め対照に設定されたSorafenib群の成績も不良であったと考えられ、その他の成因による肝細胞癌でも同様の成績が示されるのか、今後の検討が必要である。
(金沢大学先進予防医学研究センター 特任准教授 寺島 健志)
切除不能進行肝細胞癌に対する肝動注療法
切除不能進行肝細胞癌に対する肝動注療法は、肝腫瘍局所への薬剤の到達性を高め、全身への毒性が減じられる手法として特に本邦を中心にアジアで開発されてきた1)。切除不能進行肝細胞癌を対象に、肝動注療法を従来の標準治療とされてきたSorafenib単剤療法と比較検討する臨床研究が多数行われてきたが、いずれも良好な成績が報告され、肝動注療法は特にアジアにおいては同疾患に対する治療オプションの一つとされてきた2)。これまでに肝動注療法の治療レジメンは多数検討されてきたが、中でもFOLFOX療法の肝動注療法(HAIC-FO)の有効性および安全性に関しては、過去の後向き試験でSorafenib単剤療法と比較し、傾向スコアマッチング解析で良好な成績が報告されている3)。今回、切除不能進行肝細胞癌に対する1次化学療法におけるFOLFOX肝動注療法とSorafenib単剤療法を比較する初の無作為化第III相試験として本試験(FOHAIC-1試験)が実施された。本試験においてはとくに肝内高腫瘍量の症例を対象としており、またゲノムバイオマーカーの探索に腫瘍および正常肝組織の遺伝子解析が行われた点が特徴的である。
1次治療におけるFOLFOX肝動注療法とSorafenib単剤療法の無作為化第III相試験
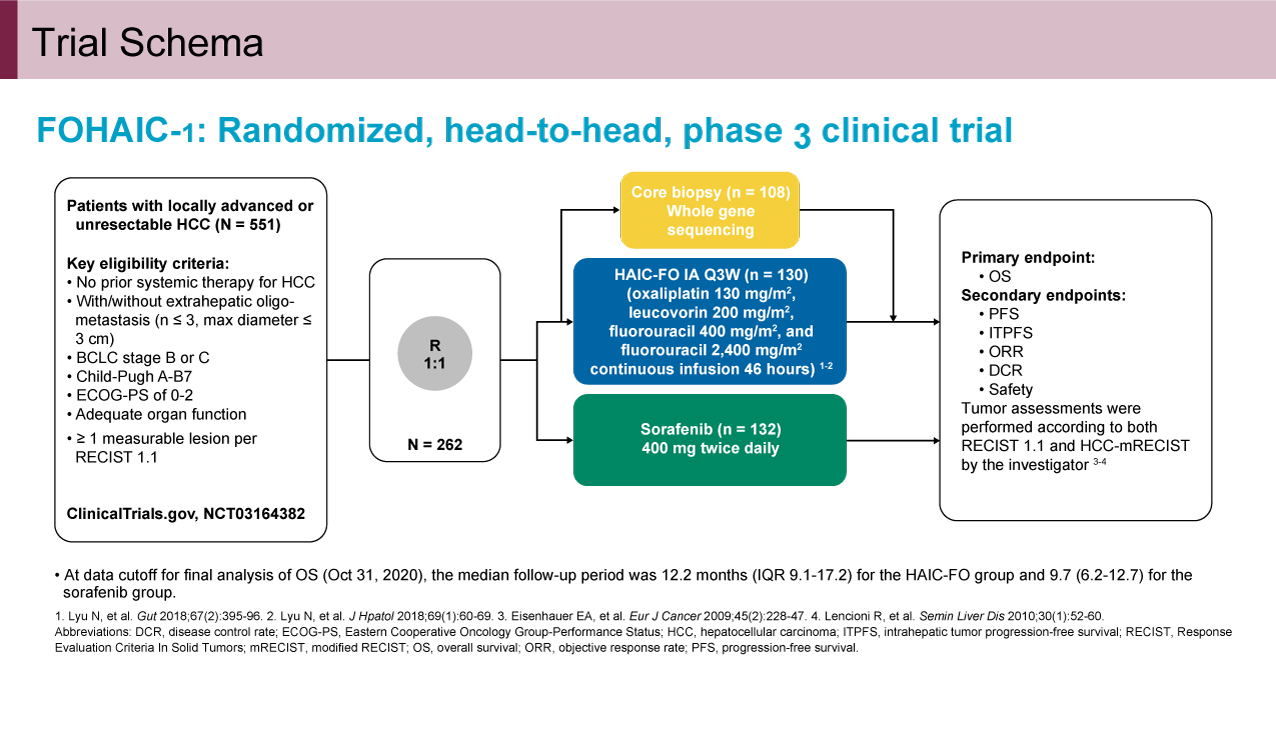
本試験の主な適格基準は、(1)全身療法未施行の局所進行あるいは切除不能進行肝細胞癌、(2)3cm、3個以内の肝外のオリゴ転移の有無は問わない、(3)BCLC stage BまたはC、(4)Child-Pugh AあるいはB(7点のみ)、(5)ECOG PS 0-2、(6)十分な臓器機能を有すること、(7)測定可能病変を有すること、であった。登録患者をFOLFOX肝動注療法(Oxaliplatin 130mg/m2 day 1、Leucovorin 200mg/m2 day 1、5-FU bolus 400mg/m2 day 1、5-FU continuous 2,400mg/m2 day 1-3、q3wks)群とSorafenib単剤療法群(Sorafenib 400mg twice daily)に1:1に割り付けた。またFOLFOX肝動注療法群においてはゲノムバイオマーカー探索用に腫瘍組織と正常肝組織の針生検を実施し、全ゲノムシークエンス用の検体を採取した。主要評価項目は全生存期間(OS)、副次評価項目は無増悪生存期間(PFS)、intention-to-treat PFS、奏効割合(ORR)、病勢制御率(DCR)、安全性であった。なお効果判定はRECIST v1.1とHCC-mRECISTによって主治医判定で実施された。FOLFOX肝動注療法群のOS中央値を14.0ヵ月、Sorafenib単剤療法のOS中央値を8.0ヵ月と仮定し、有意水準両側5%、検出率90%と設定し、必要イベント数は247例、5%の脱落を見込み、必要症例数は260例と算出された(図1)。
図1 Trial Schema(発表者の許可を得て掲載)
FOLFOX肝動注療法はSorafenib単剤療法に対して全生存期間における優越性を示した
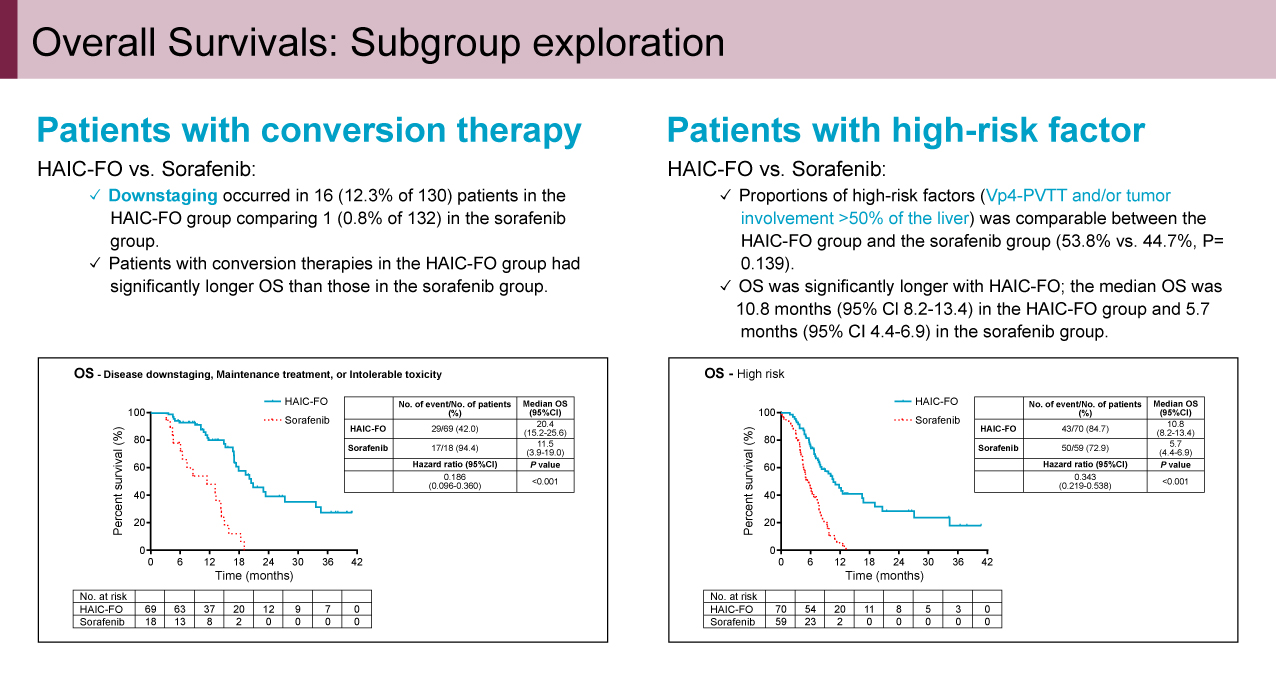
本研究は中国で実施され、262例が登録され、FOLFOX肝動注療法群に130例、Sorafenib単剤療法群に132例が割り付けられた。なお、FOLFOX肝動注療法群の108例においてゲノム解析用の検体採取が施行された。患者背景に関しては両者に群間差は認められなかった。主要評価項目のOSに関してはハザード比(HR)=0.408(95%信頼区間: 0.301-0.553、p<0.001)、OS中央値13.9ヵ月vs. 8.2ヵ月と、FOLFOX肝動注療法群で有意な延長効果が認められた(図2)。とくにFOLFOX肝動注療法群では12.3%の症例で腫瘍縮小によるdown stagingが得られ、またハイリスク症例(Vp4-PVTT and/or tumor involvement >50% of the liver)のサブグループにおいてもOS中央値10.8ヵ月vs. 5.7ヵ月(HR=0.343、p<0.001)とFOLFOX肝動注療法群での有意な延長効果が認められた(図3)。副次評価項目のORRに関しては31.5% vs. 1.5%(RECIST v1.1)、35.4% vs. 5.3%(mRECIST)とFOLFOX肝動注療法群で高い奏効が得られた。一方、有害事象に関してはgrade 3以上の有害事象はSorafenib単剤療法群で48.1%、FOLFOX肝動注療法群で20.3%とSorafenib単剤療法群に多く認められ、FOLFOX肝動注療法群ではとくに血小板減少(10.9%)、AST上昇(10.9%)が多く認められたが、いずれも許容範囲内のものであった。なおFOLFOX肝動注療法群を対象に施行した全ゲノム解析の結果、18の共通ドライバー遺伝子異常が検出されCR/PR群とPD/SD群で奏効との関連解析を行ったが、有用なバイオマーカーは抽出されなかった。
図2 Survivals: Primary Endpoint(発表者の許可を得て掲載)
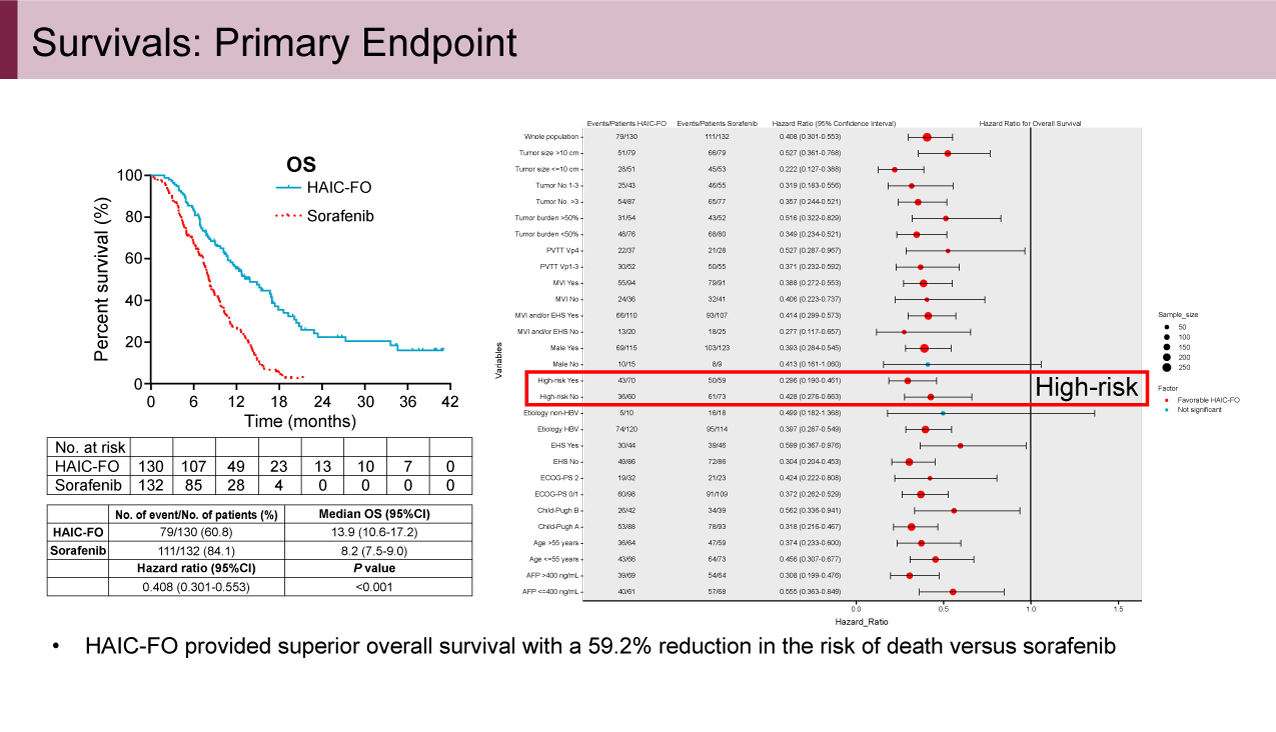
図3 Overall Survivals: Subgroup exploration(発表者の許可を得て掲載)
まとめ
切除不能進行肝細胞癌に対する1次治療としてのFOLFOX肝動注療法は、Sorafenib単剤療法に対し生存期間における有意な延長効果を示した。その有効性は高リスク症例においても同様に確認され、FOLFOX肝動注療法はとくに肝内高腫瘍量の切除不能進行肝細胞癌の1次治療における新たな標準治療になりうると考えられた。
(レポート:慶應義塾大学病院 腫瘍センター 林 秀幸)
References
1) Obi S, et al.: Liver Cancer. 4(3): 188-199, 2015[PubMed]
2) Zhuang BW, et al.: Jpn J Clin Oncol. 49(9): 845-855, 2019 [PubMed]
3) Lyu N, et al.: J Hepatol. 69(1): 60-69, 2018[PubMed]
関連サイト
・REFLECT試験[学会レポート][ClinicalTrials.gov]
・IMbrave150試験[ClinicalTrials.gov]
寺島 健志先生
金沢大学先進予防医学研究センター 特任准教授