HER2発現胆道癌に対するTrastuzumab Deruxtecan(T-DXd)の医師主導第II相試験(HERB試験)
Trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2-expressing unresectable or recurrent biliary tract cancer (BTC): An investigator-initiated multicenter phase 2 study (HERB trial)
Akihiro Ohba, et al.
監修コメント
本試験は化学療法既治療の日本人進行胆道癌患者のうち、HER2陽性患者および低発現患者を対象とし、Trastuzumab Deruxtecan(T-DXd)の有効性および安全性を検討した、第II相試験であり、医師主導治験として実施された。主要評価項目に設定されたHER2陽性患者における独立中央判定に基づく奏効割合は36.4%であり、信頼区間下限が事前に設定した閾値奏効割合15%を上回ったことが報告された。また、病勢制御割合は81.8%、無増悪生存期間は中央値5.1ヵ月、全生存期間は中央値7.1ヵ月であった。
胆道癌に対する2次薬物療法として、がん遺伝子パネル検査を実施し、得られた遺伝子変異の結果に基づく治療選択が浸透しつつある。ここ数年でPemigatinib、Ivosidenib、modified FOLFOX、nal-IRI+5-FU/LVの有用性が示され、本サイトでも、ASCOやESMOといった国際学会のたびに新たなエビデンスとして紹介させていただいている。しかし、これらはいずれも海外で実施された臨床試験であることから、これらのうち本邦で承認され日常臨床で保険診療として投与可能であるのは、Pemigatinibに加えて、臓器横断的に承認が得られているミスマッチ修復機能欠損/高頻度マイクロサテライト不安定性および高い腫瘍遺伝子変異量を有する患者に対するPembrolizumabやNTRK融合遺伝子に対するTRK阻害薬に限定されているのが現状である。
本試験は第II相試験であるものの、承認申請を見据えて医師主導治験として実施され、事前に設定された仮説をメットしており、演題がOral発表されたことからも、臨床的意義のある結果であったと考えられる。T-DXdはHER2陽性胃癌に続いて乳癌ではHER2低発現の患者にも有用性が示されている。本研究結果が胆道癌患者に対する適応拡大に向けた評価資料として十分に足る結果として判断され、日常診療で使用可能となることを期待したい。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
胆道癌における2次治療と標的治療
進行胆道癌に対する薬物療法の選択肢は未だ限られている。1次化学療法の国際的な標準治療はGemcitabine+Cisplatin(GC療法)であり、最近Durvalumabの上乗せが示されたため1)、今後GC+Durvalumab療法に移行していくものと考えられる。2次化学療法としてはFOLFOX療法2)およびnal-IRI+FF療法3)がそれぞれBSC、FF療法に対する生存期間における優越性を示しているものの、Oxaliplatinおよびnal-IRIは本邦では承認されていないため日常診療ではS-1が用いられることが多い。これら2次化学療法の奏効割合は5~15%であり、より有効な治療の開発が求められている。
胆道癌では割合は少ないながらも治療標的となる分子および遺伝子異常が報告されてきており、標的治療への期待が高まっている。IDH1変異に対するIvosidenib4)、FGFR2融合遺伝子に対するPemigatinib5)、Infigratinib6)、Futibatinib、BRAFV600E変異に対するDabrafenib+Trametinib7)などの有効性が報告されており、これらのうちPemigatinibについては第II相試験(FIGHT-202)の奏効割合(35.5%)の結果に基づいて本邦でも承認が得られている。
HER2陽性は胆道癌でも5~30%程度でみられ魅力的な標的の1つである。バスケット型試験であるMyPathway試験のHER2陽性胆道癌コホートではPertuzumab+Trastuzumab療法で23.1%の奏効割合が報告されている8)。Trastuzumab Deruxtecan(T-DXd)はHER2阻害作用をもつADC製剤であり、HER2陽性乳癌や胃癌で高い有効性が示され本邦での承認も得られている。これらの背景からHER2発現胆道癌に対するT-DXdによる第II相の医師主導治験であるHERB試験が実施された。
HER2陽性胆道癌における奏効割合を主要評価項目としHER2低発現も探索的に検討
本試験デザインはヒストリカルコントロールに基づいて設定された、HER2陽性患者における独立中央判定の奏効割合を主要評価項目とする、単群の第II相試験であった。閾値15%、期待値40%からHER2陽性患者は24例を登録する予定であった。また、T-DXdは乳癌においてHER2低発現例に対する有効性も示唆されていたことから(実際に本演題の後のPlenary SessionでDESTINY-Breast04試験においてHER2低発現の有効性が検証されたことが報告された)、本試験でも探索的に最大8例のHER2低発現例を登録可能とした。
HER2陽性例での有効性が示唆されHER2低発現での奏効例もみられた
HER2発現のスクリーニングは治験外の別研究として行われ、計300例がIHCおよびISHによるスクリーニングを受けた。IHCおよびISHの結果が得られた296例のうち、HER2陽性(IHC 3+またはIHC 2+/ISH +)は61例(20.6%)、HER2低発現[陽性および陰性(IHC 0/ISH -)を除く]は120例(40.5%)であった。
2019年6月から2020年7月までに、HER2陽性24例、HER2低発現8例の計32例が登録され、全例が少なくとも1回のT-DXdの投与を受けた。HER2陽性のうち2例は登録時不適格であり有効性の解析対象からは除外された。主要評価対象集団(22例)では、胆?癌50.0%、肝外胆管癌27.3%、肝内胆管癌13.6%、乳頭部癌9.1%であり、切除不能59.1%、再発40.9%で、2次治療27.3%、3次治療以降72.7%であった。HER2発現は、3+が45.5%、2+が54.5%であった。
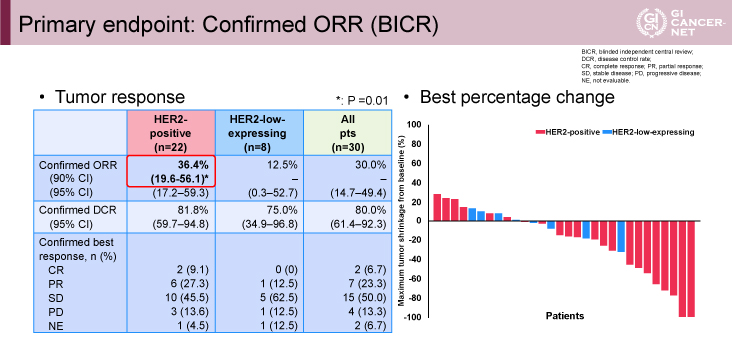
主要評価項目であるHER2陽性例に対する独立中央判定による奏効割合は36.4%(CR 2例、PR 6例)であり、信頼区間下限は事前に設定した閾値を上回った(p=0.01)(図)。HER2低発現8例においても1例がPRであり奏効割合は12.5%(90% CI: 19.6-56.1)であった。病勢制御割合はHER2陽性、HER2低発現がそれぞれ81.8%(95% CI: 59.7-94.8)、75.0%(95% CI: 34.9-96.8)であった。HER2陽性例における、奏効持続期間中央値は7.4ヵ月(95% CI: 2.8-NA)、無増悪生存期間中央値は5.1ヵ月(95% CI: 3.0-7.3)、全生存期間中央値は7.1ヵ月(95% CI: 4.7-14.6)であった。
図 Primary endpoint: Confirmed ORR (BICR)(発表者の許可を得て掲載)
治療関連有害事象としては、grade 3以上の主なものは貧血(53.1%)、好中球数減少(31.3%)、白血球数減少(31.3%)などの血液毒性であり、消化器毒性は低頻度であった。間質性肺疾患は全gradeが25.0%であり、grade 3以上が12.5%であった。間質性肺疾患発現までの中央値は124日(範囲35-247)であり、grade 3以上の4例のうち2例はgrade 5であった。間質性肺疾患に関する明らかなリスク因子は同定されなかった。
結論
HER2陽性胆道癌に対するT-DXdは統計学的に有意に良好な奏効割合を示し、その有効性が示唆された。HER2低発現でも奏効例がみられ、その有効性が期待される結果であった。一方で、間質性肺疾患などの毒性は過去の他癌種のT-DXdの臨床試験と比較し高頻度、高重症度であり注意が必要である。いずれも少ない症例数に基づく第II相試験の結果のため、結論の確定にはさらに大規模な臨床試験での確定を要する。胆道癌を含む臓器横断的な国際共同治験(DESTINY-PanTumor02試験)も進行中であり、その結果も待たれる。
(レポート:国立がん研究センター中央病院 肝胆膵内科 大場 彬博)
References
1) Oh DY, et al.: NEJM Evidence. June 1, 2022[NEJM Evidence]
2) Lamarca A, et al.: Lancet Oncol. 22(5): 690-701, 2021[PubMed]
3) Yoo C, et al.: Lancet Oncol. 22(11): 1560-1572, 2021[PubMed]
4) Abou-Alfa GK, et al.: Lancet Oncol. 21(6): 796-807, 2020[PubMed]
5) Abou-Alfa GK, et al.: Lancet Oncol. 21(5): 671-684, 2020[PubMed]
6) Javle M, et al.: Lancet Gastroenterol Hepatol. 6(10): 803-815, 2021[PubMed]
7) Subbiah V, et al.: Lancet Oncol. 21(9): 1234-1243, 2020[PubMed]
8) Javle M, et al.: Lancet Oncol. 22(9): 1290-1300, 2021[PubMed]
関連サイト
・HERB試験[JMACCT]
・FIGHT-202試験[ClinicalTrials.gov]
・MyPathway試験[論文紹介][学会レポート][ClinicalTrials.gov]
・DESTINY-PanTumor02試験[ClinicalTrials.gov]
寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授