切除不能な肝転移を有する、右側かつ/またはRAS/BRAFV600E変異大腸癌患者に対するFOLFOXIRI+Bevacizumab療法vs. FOLFOX/FOLFIRI+Bevacizumab療法の第III相試験(CAIRO5試験)
FOLFOXIRI + bevacizumab versus FOLFOX/FOLFIRI + bevacizumab in patients with initially unresectable colorectal liver metastases (CRLM) and right-sided and/or RAS/BRAFV600E mutated primary tumor: Phase III CAIRO5 study of the Dutch Colorectal Cancer Group
Cornelis J. A. Punt, et al.
監修コメント
期待どおり、質の高い臨床試験であった。発表者も述べているように、肝限局転移に対する既報の臨床試験は、切除可能性の基準が明確でないため、対象や治療に試験間のバラつきが大きく、メタアナリシスを用いても評価が難しかった。本発表のポイントは、15名の肝臓外科医を含むエキスパートパネルによる画像中央判定を用いている点である。これにより、切除可能性の基準が厳しく統一され、登録される対象が均一化できている。実際、肝転移個数は中央値12個(最低7個)であり、本邦でも“切除不能”と判定されるであろう患者が登録されている。この点は非常に本試験の価値を高め、本邦へのエビデンス外挿を可能なものにしている。
結果、FOLFOXIRI+Bevacizumab(BEV)群でPFS、ORRが良好であった。ディスカッサントは、「PFS延長の臨床的意義は何か」と少し疑問を呈していたが、R0/1切除率も良好であったことから、OSデータは未発表であるものの、FOLFOXIRI+BEVの使用を後押しするデータと考える。対象は、適格基準では「RAS/BRAF変異型もしくは原発巣占居部位が右側」となっていたが、実際は86%がRAS変異型で、BRAF変異型や右側RAS野生型の患者は10%未満であった。しかし、本試験のサブグループ解析で交互作用が認められなかった点や、既報と合わせて考えると、右側RAS野生型においてもFOLFOXIRI+BEVを積極的に用いることは妥当であろう。
本試験結果を受け、今後実地診療でのFOLFOXIRI+BEVの使用が増えそうだ。本試験ではFOLFOXIRI群で死亡を含む周術期合併症の頻度が高かったが、これは世界トップレベルに合併症率が低い本邦には当てはまらないだろう。一方、FOLFOXIRI+BEVオリジナルレジメンでは発熱性好中球減少症が比較的高いため、治療の有害事象には十分注意が必要である。予防的G-CSF使用やmodifiedレジメンを活用して、本エビデンスを実地診療に生かしていくことが期待される。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
切除不能肝限局転移を有する大腸癌に対する最適な治療のコンセンサスは得られていない
肝限局転移を有する大腸癌(CRLM)は、切除可能性により治療方針が異なり、薬物療法により腫瘍縮小が得られれば切除可能となり得る切除不能例(initially unresectable but potentially resectable CRLM)では導入薬物療法が選択されるが、最適な治療レジメンのコンセンサスは得られていない。その理由として、既報の臨床試験では、切除可能/不能の基準が定まっていない、長期予後が不明である、対象症例/試験デザインやRAS/BRAFステータスの扱いが各試験によってばらつきがあることが挙げられる1)。
RAS/BRAFV600E変異型または右側結腸原発の切除不能大腸癌肝限局転移例に対するFOLFOXIRI+BEVとFOLFOX/FOLFIRI+BEVの比較試験
本CAIRO5試験は、切除不能肝限局転移を有する大腸癌に対し、RAS/BRAFV600E野生型かつ原発占居部位が左側大腸の症例はFOLFOX/FOLFIRI+Panitumumab vs. FOLFOX/FOLFIRI+BEVを、RAS/BRAFV600E変異型かつ/または原発占居部位が右側大腸の症例はFOLFOXIRI+BEVとFOLFOX/FOLFIRI+BEVを比較する第III相試験である(図1)。RAS/BRAFV600E野生型かつ左側群は2022年3月に症例集積が終了し解析中であり、今回はRAS/BRAFV600E変異型かつ/または右側についての報告となった。
図1 CAIRO5: prospective randomized comparison of currently most active systemic regimens in defined subgroups of patients with initially unresectable CRLM(発表者の許可を得て掲載)
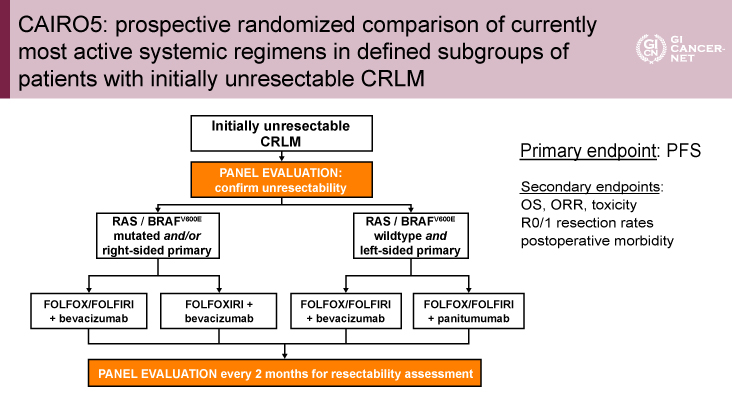
肝転移切除可能性は、15名の肝臓外科医、3名の放射線診断医で構成されたエキスパートパネルにより、CT画像およびMRI画像から評価された
主な適格基準は、エキスパートパネルにより切除不能と判断された肝限局転移を有する大腸癌(転移と断定できない1cm以下の肝外病変のある症例は適格とされた)、右側大腸に原発腫瘍を有するかつ/またはRAS/BRAFV600E変異腫瘍を有すること、年齢18歳以上、原発腫瘍の切除後または切除が見込まれること、等であった。適格症例はFOLFOXIRI+BEV群とFOLFOX/FOLFIRI+BEV群に1:1に無作為化割付された。このとき、肝転移切除可能性(エキスパートパネルによるpotentially resectableかpermanently unresectableかの判断)、血清LDH値(正常または異常)、BRAFV600E変異の有無、OxaliplatinまたはIrinotecan使用(担当医選択)が層別因子とされた。
エキスパートパネルは、15名の肝臓外科医、3名の放射線診断医で構成され、全症例のベースラインおよびフォローアップCT画像(およびMRI画像)がオンラインで共有され評価された。肝転移切除可能性の評価は、3名の肝臓外科医の一致で行われ、一致しない場合は、2名の肝臓外科医を追加し多数決で決定された。導入薬物療法は選択された治療群で最大12サイクル実施され、以後5-FU/Leucovorin+BEVによる維持療法が増悪まで行われた。局所治療は焼灼療法や門脈塞栓術を伴う二期的肝切除術など、すべての治療が許容された。
主要評価項目は無増悪生存期間(PFS)で、副次評価項目は全生存期間(OS)、奏効率(ORR)、毒性、R0/1肝切除率、手術死亡率であった。検出力80%、α=0.05(両側ログランク検定)でPFSのハザード比(HR)0.70を検出するように統計学的設定が行われ、FOLFOX/FOLFIRI+BEVのPFS中央値が8.7ヵ月と推定されることから、PFSについて257イベントが必要であった。
FOLFOXIRI+BEVはFOLFOX/FOLFIRI+BEVと比較し有意にPFSを延長した
2014年12月から2021年3月までに44施設から294例が登録され、適格基準を満たした291例(FOLFOXIRI群144例、FOLFOX/FOLFIRI群147例)が解析された。患者背景は、年齢、性別、WHO PS、原発巣占居部位、RAS変異(86% vs. 86%)、BRAFV600E変異(8% vs. 7%)、同時性または異時性(同時性90% vs. 86%)、肝転移個数(中央値12個vs. 12個)等、両群に差を認めなかった。実施された薬物療法のサイクル数は両群とも中央値8であり、FOLFOX/FOLFIRI群では93%がFOLFOXを選択された。
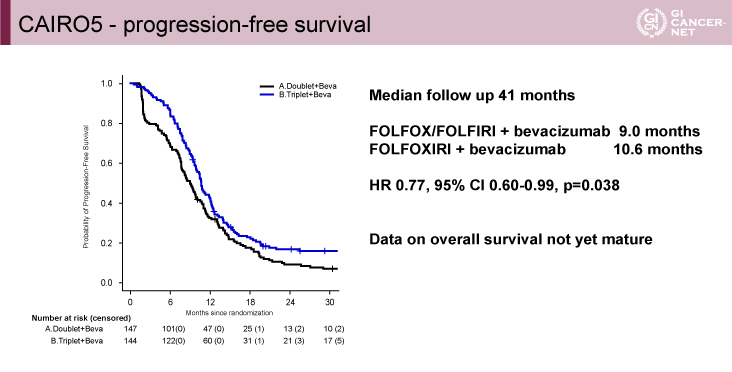
主要評価項目であるPFSは、FOLFOXIRI群で有意に良好であった(中央値10.6ヵ月vs. 9.0ヵ月、HR=0.77、95%信頼区間(CI)0.60-0.99、p=0.038)(図2)。OSについては十分な観察期間を満たしていなかった。PFSについてのサブグループ解析ではベースライン時の肝転移切除可能性の有無(interaction p=0.98)と、RAS/BRAFV600Eステータス(interaction p=0.83)のいずれも交互効果を認めなかった。
図2 CAIRO5 ? progression-free survival(発表者の許可を得て掲載)
FOLFOXIRI群はORR、肝切除率が良好であったが、有害事象、術後合併症も多かった
副次評価項目であるORRはFOLFOXIRI群で有意に良好であった(53.5% vs. 33.3%、p<0.001)。また、FOLFOXIRI群はgrade 3以上の有害事象(75.7% vs. 59.2%、p=0.003)、好中球減少(38.2% vs. 12.9%、p<0.001)、下痢(19.4% vs. 3.4%、p<0.001)が多く、2例(1.4%)の治療関連死を認めた。
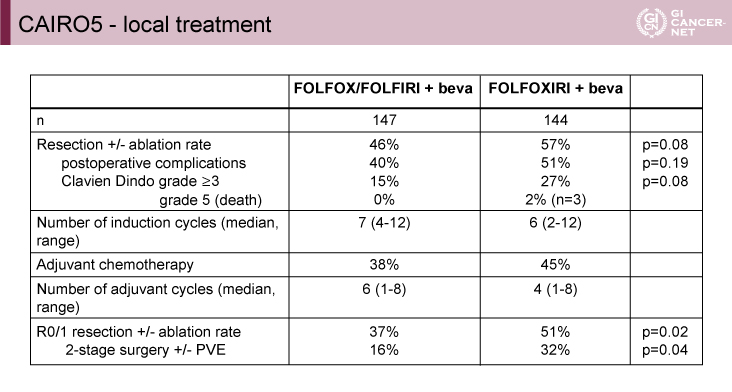
R0/1肝切除率はFOLFOXIRI+BEV併用療法群で有意に高かった(51% vs. 37%、p=0.02)(表)。Clavien Dindo grade 3以上の周術期合併症はFOLFOXIRI群で多い傾向にあり(27% vs. 15%、p=0.08)、3例(2%)の手術関連死を認めた。また、局所治療が成功した場合(R0/1肝切除±ablation)はFOLFOXIRI群(中央値12.7ヵ月vs. 9.0ヵ月、HR=0.43、p<0.0001)とFOLFOX/FOLFIRI群(中央値11.9ヵ月vs. 7.0ヵ月、HR=0.49、p<0.0001)のいずれにおいても有意にPFSが良好であった。なお、エキスパートパネルによるCT評価の結果返却期間は中央値6日(4~9日)、切除可能性の判断の一致率はベースライン評価66%、フォローアップ評価41%であった。
表 CAIRO5 ? local treatment(発表者の許可を得て掲載)
結論
本試験は、エキスパートパネルによる中央判定により切除不能と評価された肝限局転移を有する大腸癌に対する導入薬物療法のレジメンを前向きに検証した初めての無作為化比較試験であった。RAS/BRAFV600E変異型かつ/または原発占居部位が右側の症例に対して、FOLFOXIRI+BEV療法はFOLFOX/FOLFIRI+BEV療法と比較し、有意にPFSを延長し、ORR、R0/1肝切除率も良好であったが、有害事象や周術期合併症も有意に高かった。エキスパートパネルの活用は、治癒を目指す局所治療に適格となる患者の数を増加させる可能性が示唆された。
(レポート:愛知県がんセンター 薬物療法部 中田 晃暢)
Reference
1) Bolhuis K, et al.: Eur J Cancer. 141: 225-238, 2020[PubMed]
関連サイト
・CAIRO5[DCCG]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長