転移のあるRAS野生型大腸癌に対するPanitumumab(Pmab)+FOLFOX導入療法後のPmab+Fluorouracil+Folinic Acid(FU/FA)またはFU/FA維持療法の予後予測バイオマーカーとしてのAmphiregulinとEpiregulinの発現:PANAMA試験(AIO-KRK-0212)
Combined amphiregulin and epiregulin expression as a prognostic and predictive biomarker of panitumumab (Pmab), fluorouracil, and folinic acid (FU/FA) or FU/FA maintenance therapy following Pmab+FOLFOX induction in RAS wildtype metastatic colorectal cancer (mCRC): PANAMA trial (AIO-KRK-0212)
Arndt Stahler, et al.
監修コメント
PARADIGM試験の結果を受け、原発巣左側RAS野生型大腸癌一次治療は抗EGFR抗体薬併用療法が標準治療となった。一方、一次治療期間が長期にわたることを考慮すると、QOLを維持するための維持療法が重要な課題となっている。Oxaliplatinの計画的中止による末梢神経障害の改善は当然のことながら1-3)、フッ化ピリミジンおよび抗EGFR抗体薬の使い方についてもランダム化第II相試験での検討が報告されている。抗EGFR抗体薬のみの維持療法を検討したValentino試験4)や、フッ化ピリミジン±Pmab維持療法の有用性を検討したPanaMa試験によれば、PFSの観点からはフッ化ピリミジン+Pmabが最もPFSを延長できる可能性があるが、OSには大きな違いはないため、QOL維持の観点からはフッ化ピリミジン単独や抗EGFR抗体薬単独による維持療法の実施も有力な選択肢となるだろう5)。
維持療法として抗EGFR抗体薬併用が必要な対象を絞り込むことは重要であると考えられ、本報告はAmphiregulin(AREG)やEpiregulin(EREG)の発現量により、Pmabが不要な集団が抽出できないかという観点からの検討であった。結果、AREG/EREGの発現量の低い群はPmabの維持療法による効果は乏しい可能性が示されたことから、フッ化ピリミジン単独療法による維持療法も十分考慮される結果となった。しかし、既報も含めてAREG/EREG発現の測定方法やカットオフ値は統一されておらず、また、そもそもAREG/EREG低発現群では、導入療法での抗EGFR抗体薬の併用効果も疑問が残る。AREG/EREG発現量の測定は、臨床的有用性の検証も含めてまだまだ課題が多い。日常診療では腫瘍量や副作用に応じて、フッ化ピリミジンやPmabをon/offしながら維持療法を行うことが妥当であろう。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
背景
Amphiregulin(AREG)やEpiregulin(EREG)はEGFRのリガンドであり、大腸癌における重要な細胞増殖因子である。AREGとEREGのmRNA発現量は強い予後因子であり、また、高発現は抗EGFR抗体の治療効果が高いことが報告されているが、維持療法の効果における臨床的意義は不明である。今回、RAS野生型大腸癌に対してFOLFOX+Pmab導入療法後のFU/FA±Pmab維持療法の有用性を検討したランダム化第II相試験であるPanaMa試験の臨床データを用いて検討した。
mRNAを用いたAREG/EREGはFOLFOX+Pmab療法後のFU/FA±Pmab維持療法の効果予測因子となるかどうかを検討
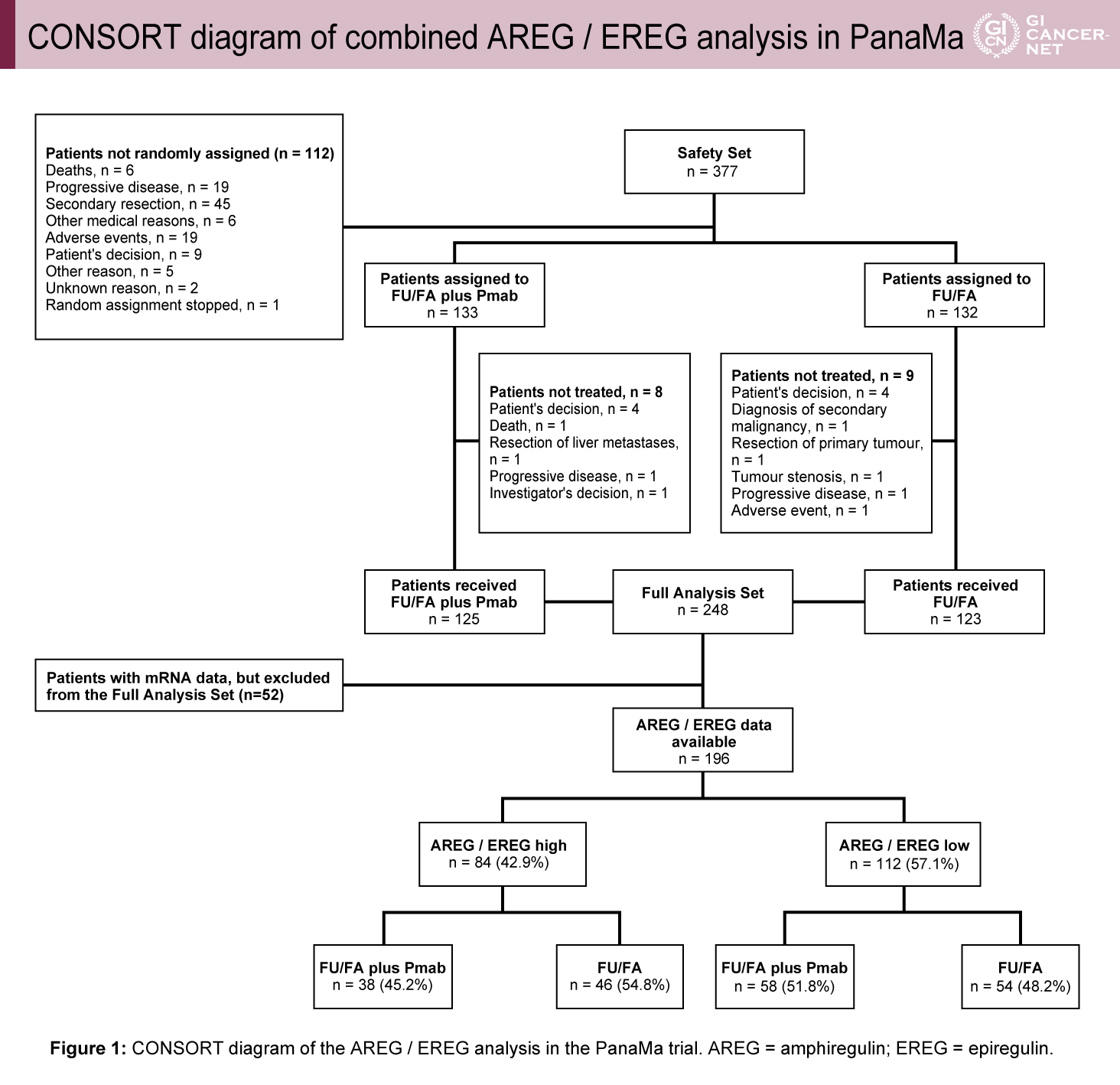
RAS野生型、未治療例のmCRC患者を対象に、6コースのFOLFOX+Pmab導入療法後に、SD以上の治療効果が得られた377例のうち、FU/FA±Pmab維持療法が実施されmRNA解析が可能であった196例が解析対象となった(図1)。AREG/EREGのmRNA発現量から、高発現群(mRNAにおいてAREG・EREGがともに中央値よりも高値)84例(42.9%)と低発現群(AREG・EREGのいずれかのみ中央値よりも高値、またはAREG/EREGが中央値以下)112例(57.1%)に分けて解析が行われた。維持療法開始日を起算日として、log rank testを用いてKaplan-Meier法、cox regressionによりPFS、OSとの相関が評価された。
図1 CONSORT diagram of combined AREG / EREG analysis in PanaMa(発表者の許可を得て掲載)
AREG/EREG高発現は予後予測因子かつPmab併用維持療法の効果予測因子であることが示された
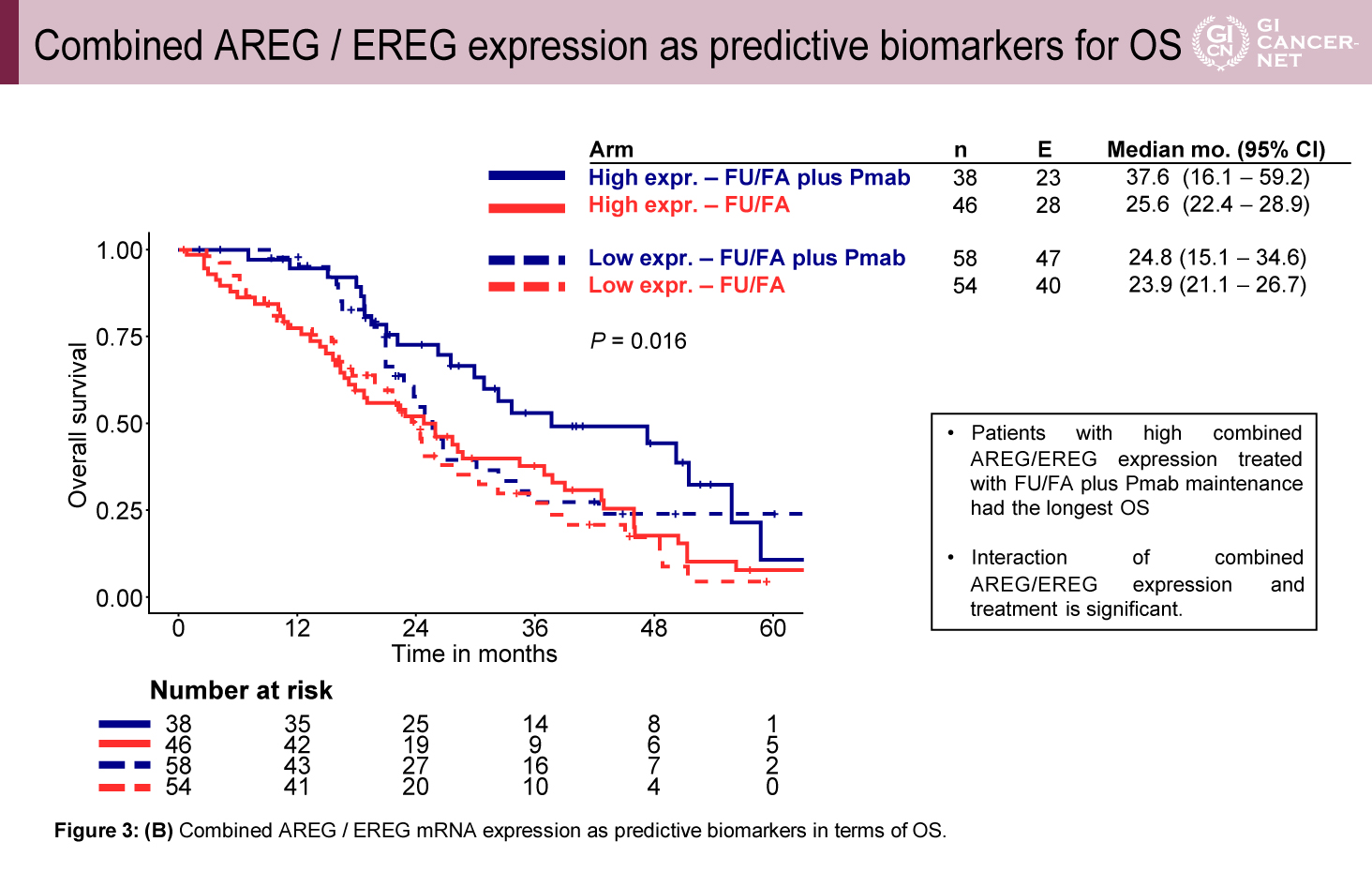
AREG/EREG高発現群は低発現群に比較して、原発巣右側が少なく(7.1% vs. 20.5%)、肝転移限局例が多く(53.6% vs. 33.9%)、hyperselection野生型が多い(88.1% vs. 73.2%)傾向があった(表1)。予後との相関では、維持療法の治療レジメンにかかわらずAREG/EREG高発現群は低発現群に比べてPFS(中央値7.7ヵ月 vs. 5.8ヵ月、HR=0.69、95% CI: 0.51-0.93、p=0.02)およびOS(中央値30.1ヵ月 vs. 24.4ヵ月、HR=0.58、95% CI: 0.41-0.82、p=0.002)ともに良好な傾向を示した(図2)。また、PFSの検討では、AREG/EREG発現量と治療効果に交互作用を認め(p=0.003)、高発現群ではFU/FA+Pmab維持療法がFU/FA単独療法と比較して良好であったが(PFS中央値10.9ヵ月[6.8-14.9]vs. 5.9ヵ月[3.8-8.1])、AREG/EREG低発現群ではPmab併用による上乗せ効果は少ない傾向であった(PFS中央値7.6ヵ月[4.7-10.5]vs. 5.5ヵ月[4.8-6.1])(図3)。OSに関してもPFSと同様に、AREG/EREG高発現群においてFU/FA+Pmab維持療法群で良好な傾向を認めたが(OS中央値37.6ヵ月[16.1-59.2]vs. 25.6ヵ月[22.4-28.9]、AREG/EREG低発現群ではPmab併用による上乗せ効果はわずかであった(OS中央値24.8ヵ月[15.1-34.6]vs. 23.9ヵ月[21.1-26.7])(図4)。
表1 Baseline characteristics(発表者の許可を得て掲載)
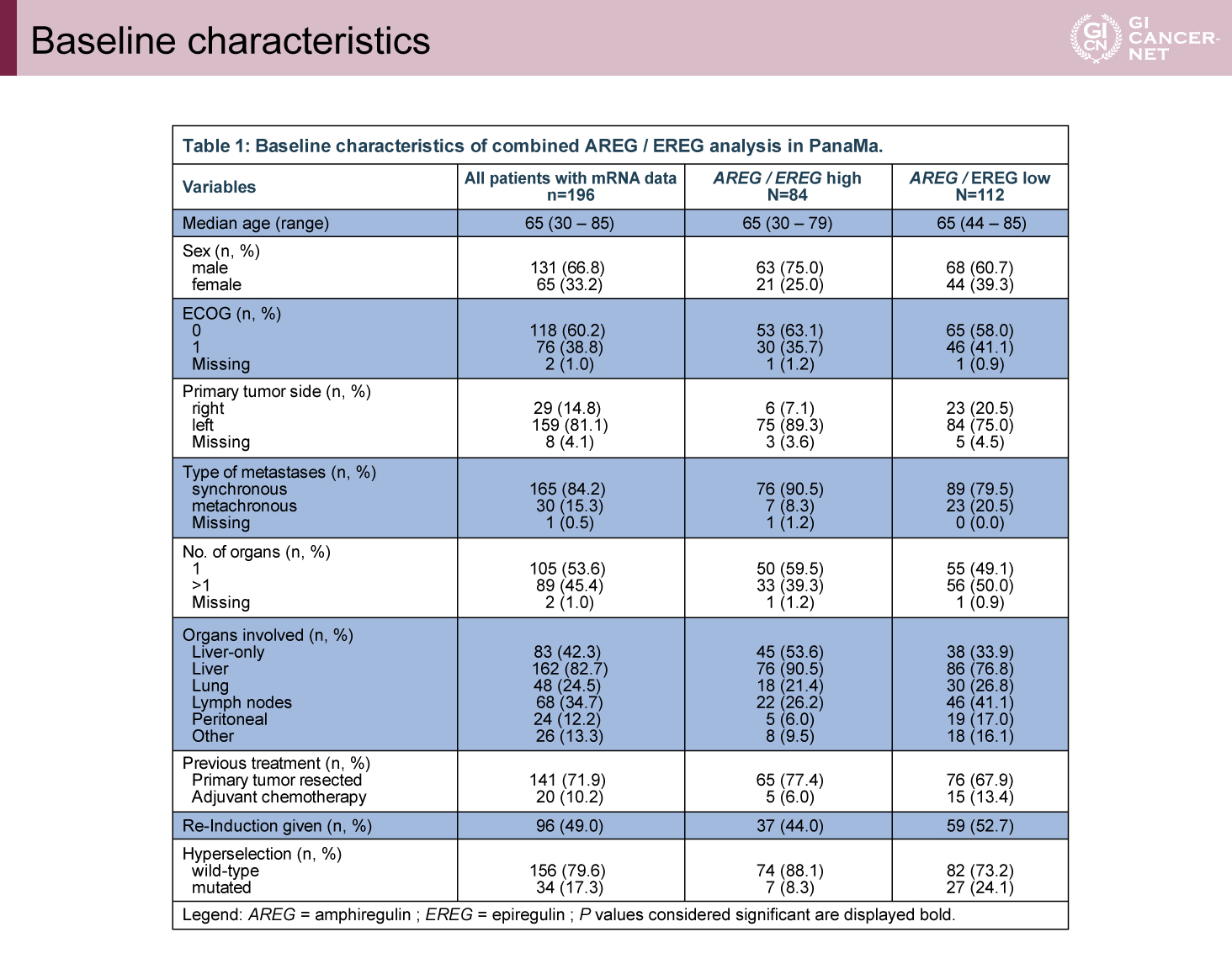
図2 Combined AREG / EREG expression as prognostic biomarkers(発表者の許可を得て掲載)
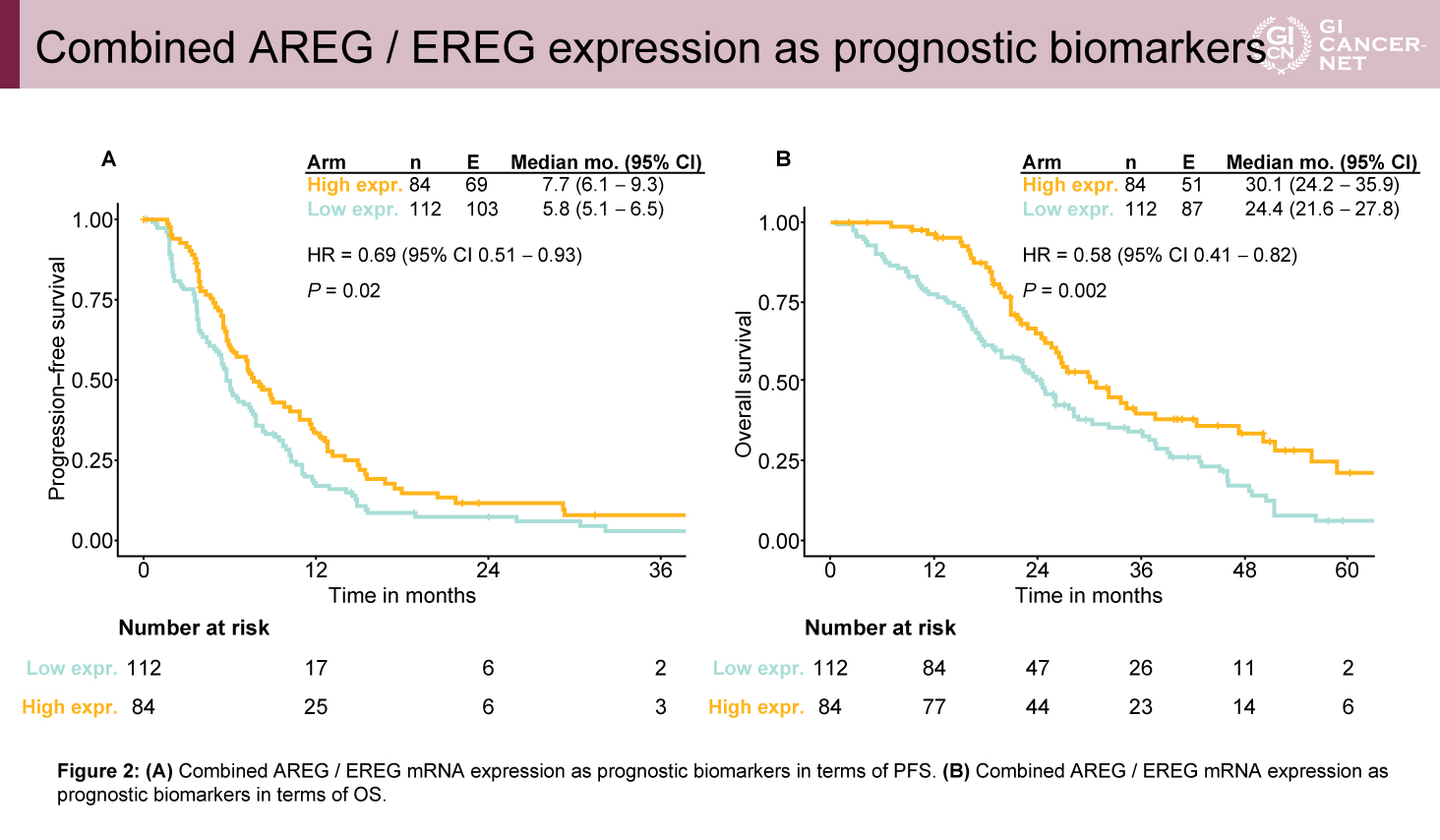
図3 Combined AREG / EREG expression as predictive biomarkers for PFS
(発表者の許可を得て掲載)
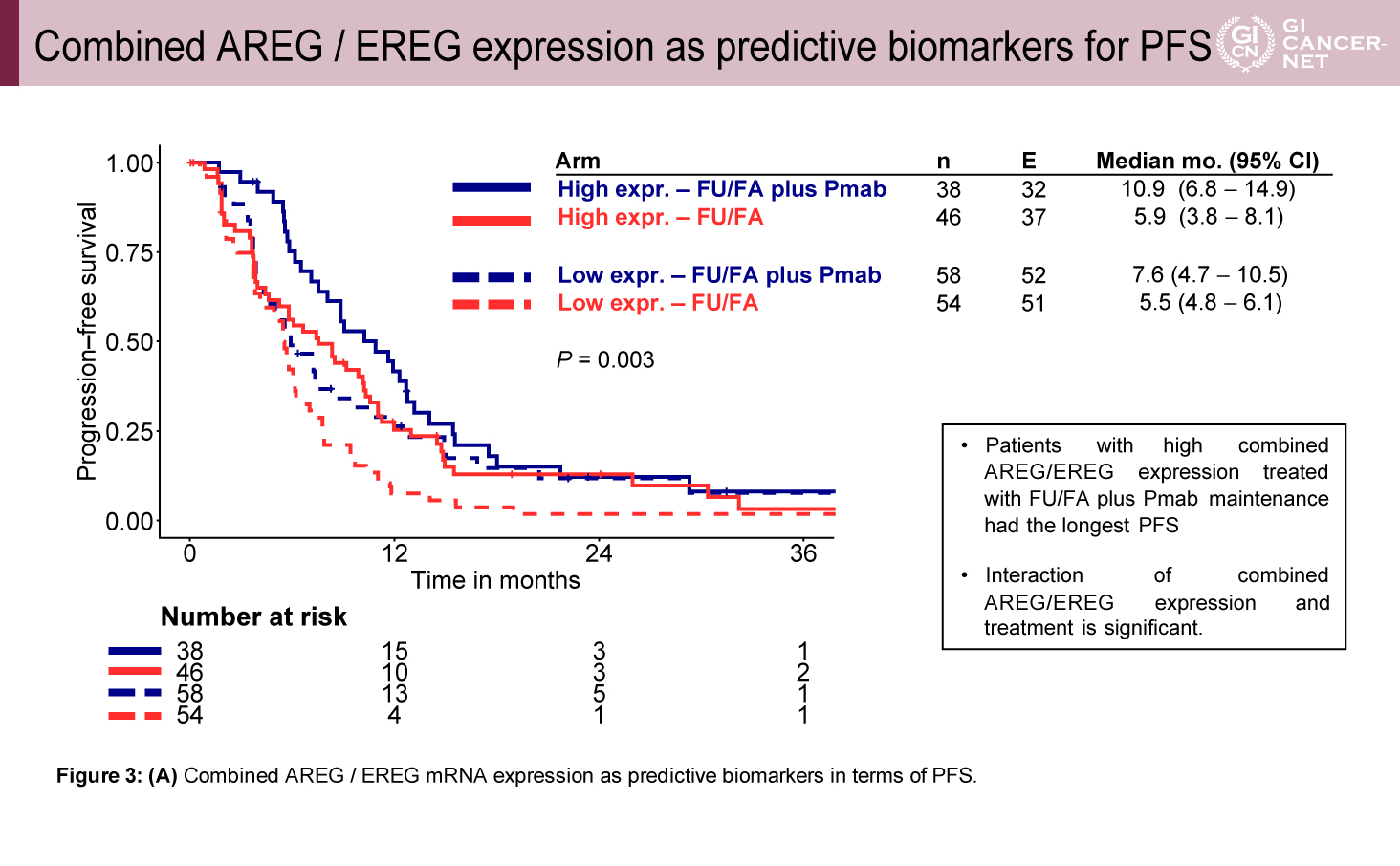
図4 Combined AREG / EREG expression as predictive biomarkers for OS
(発表者の許可を得て掲載)
まとめ
中央値をカットオフ値としたmRNAにおけるAREG/EREG発現量はRAS野生型のmCRCにおける予後因子となり得ることが示された。また、FU/FA±Pmab維持療法の効果予測因子である可能性が示唆された。
(レポート:愛知県がんセンター 薬物療法部 石塚 保亘)
References
1) Tournigand C, et al.: J Clin Oncol. 24(3): 394-400, 2006 [PubMed]
2) Simkens LHJ, et al.: Lancet. 385(9980): 1843-1852, 2015 [PubMed]
3) Munemoto Y, et al.: Eur J Cancer. 119: 158-167, 2019 [PubMed]
4) Pietrantonio F, et al.: JAMA Oncol. 5(9): 1268-1275, 2019 [PubMed]
5) Modest DP, et al.: J Clin Oncol. 40(1): 72-82, 2022 [PubMed]
関連サイト
・PanaMa試験[ClinicalTrials.gov]
・Valentino試験[ClinicalTrials.gov]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長