免疫チェックポイント阻害薬治療後の進行肝細胞癌に対するRegorafenib+Pembrolizumabの国際共同第II相試験
International, open-label phase 2 study of regorafenib plus pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with immune checkpoint inhibitors
Anthony B El-Khoueiry, et al.
監修コメント
本試験では、1次治療として免疫チェックポイント阻害薬(コホート1ではAtezolizumab+Bevacizumab併用療法、コホート2ではそれ以外)が投与された後の2次治療としてRegorafenib+Pembrolizumabの有効性および安全性が検討された。主要評価項目である客観的奏効割合はコホート1で5.9%、コホート2で11.1%といずれも閾値を下回っていた。
進行肝細胞癌に対しては近年、Atezolizumab+Bevacizumab併用療法、Durvalumab+Tremelimumab併用療法の有用性が示され、1次治療の標準治療として確立されている。また、今年のASCOでIpilimumab+Nivolumabが対照群と比較して有意に全生存期間を延長させることが示され、今後1次治療の選択肢になりうる。2次治療としては、それまで1次治療の標準治療であったSorafenib、Lenvatinib、2次治療の選択肢とされていたRegorafenib、Ramucirumab、Cabozantinibが選択肢としてあり、現在、治験を含めてさまざまな治療の開発が試みられている。その多くは分子標的薬を中心に、より高い有効性を期待した治療法であり、本研究で用いられたRegorafenib+Pembrolizumabは期待された候補の1つであったことから残念な結果であった。
免疫チェックポイント阻害薬から免疫チェックポイント阻害薬への変更についても今後、データが蓄積されることが期待されるが、他癌種を参考に免疫チェックポイント阻害薬の耐性機序の解明やその克服法についても研究が進むことを期待したい。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
免疫療法時代における標準的2次治療のエビデンスは乏しい
切除不能肝細胞癌に対しては既にIMbrave150試験の結果からAtezolizumab+Bevacizumabが、HIMALAYA試験の結果からDurvalumab+Tremelimumabが1次治療における標準治療となっており、免疫チェックポイント阻害薬+血管新生阻害薬または免疫チェックポイント阻害薬の併用療法の有用性が示されてきた。
それまでの標準治療であったチロシンキナーゼ阻害薬であるLenvatinibやSorafenib、2次治療で効果が示されていたRegorafenibやCabozantinibなどが2次治療の選択肢となるが、免疫チェックポイント阻害薬による1次治療後の大規模なランダム化比較試験はなくエビデンスには乏しい。また、チロシンキナーゼ阻害薬後の2次治療として免疫チェックポイント阻害薬単剤あるいは併用療法についても一定の有効性が示されているものの、同様に免疫チェックポイント阻害薬による1次治療後に有効であるかについては不明である。
Regorafenib+Pembrolizumabについては1次治療の第II相試験でORR 31%など有効性が期待されており、その奏効にはT細胞やマクロファージの変化の関連が示唆されていた。このため、免疫チェックポイント阻害薬による1次治療後の2次治療としてRegorafenib+Pembrolizumabの有効性を検討する第II相試験が実施された。
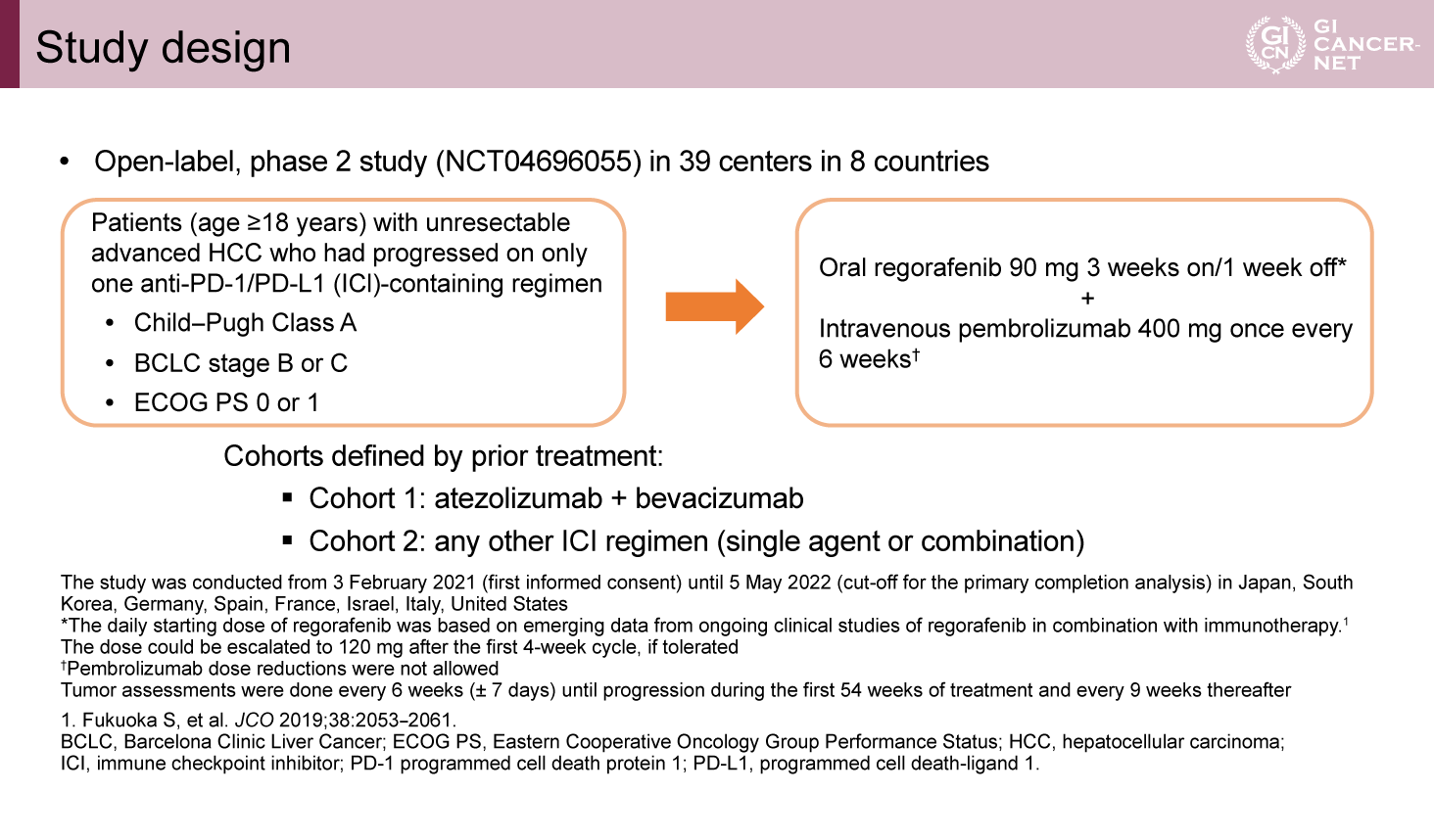
1次治療として免疫チェックポイント阻害薬単剤または併用療法後のRegorafenib+Pembrolizumabの国際共同第II相試験(図1)
8ヵ国による国際共同非盲検単群の第II相試験として実施された。適格基準としては免疫チェックポイント阻害薬を含む1次治療に不応となった進行肝細胞癌で、CP-A、BCLC分類BまたはC、PS 0または1が条件であった。2つのコホートで構成され、コホート1は1次治療がAtezolizumab+Bevacizumab、コホート2はそれ以外となっていた。
Regorafenib 90mg、3週投与、1週休薬、Pembrolizumab 400mg、6週ごとの投与が行われた。
主要評価項目は画像中央診断によるORRで、副次評価項目には担当医判定のORR、DOR、安全性が含まれており、探索的評価項目として、マクロファージや血管新生、免疫関連マーカーの検討がOSやPFS、DCRとともに設定されていた。
設定した期待ORR 35%、閾値ORR 20%はパイロット期で達成されなかったため拡大期には進まず、コホート1が68例、コホート2が27例の時点で終了し結果が公表された。
図1 Study design(発表者の許可を得て掲載)
Regorafenib+Pembrolizumabによる有効性は限定的で、1次治療免疫チェックポイント阻害薬による免疫環境の変化が原因と考察された
コホート1と2の合計で95例が登録され、年齢中央値は68歳、アジア人は23%、BCLC分類Cが78%であった。
主要評価項目であるORRはコホート1で5.9%(95% CI: 1.6-14.4)、コホート2で11.1%(95% CI: 2.4-29.2)といずれも期待を下回るものであった。DOR中央値もコホート1で2.5ヵ月、コホート2で2.8ヵ月であり奏効例における有効性も限定的であった(表1)。
治療関連のgrade 3以上の有害事象は全患者で37%であり、全gradeの治療関連免疫関連有害事象は22%、主要な有害事象はgrade 2以下の手足症候群、食欲不振、下痢、高血圧などであり、Regorafenib単剤やPembrolizumab単剤を大きく上回る有害事象はみられなかった。
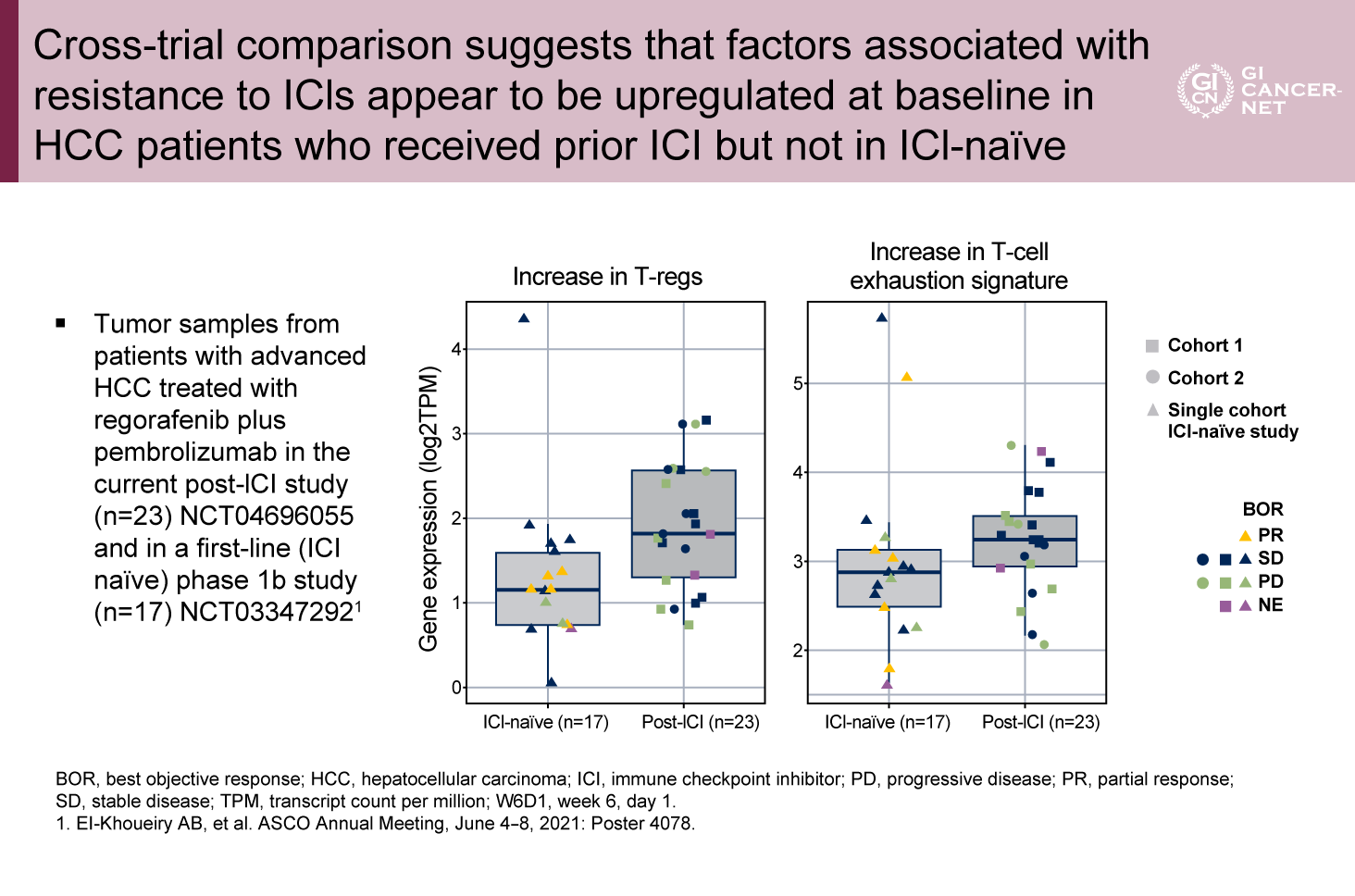
探索的評価として、ペア生検(治療前、6週後)検体のある4例における検討と、1次治療の臨床試験検体との比較による検討(免疫チェックポイント既治療の影響の検討)、が実施された。ペア生検の4例はいずれも非奏効例であり、これらではマクロファージ数と血管新生マーカーの減少はみられたもののT細胞の活性化や、制御性T細胞やT細胞疲弊についての変化は認めなかった。比較検討では、免疫チェックポイント未治療に比べ既治療では制御性T細胞やT細胞疲弊が増加しており、これらが耐性メカニズムに関与していることが示唆された(図2)。
表1 Tumor response and duration of treatment(発表者の許可を得て掲載)
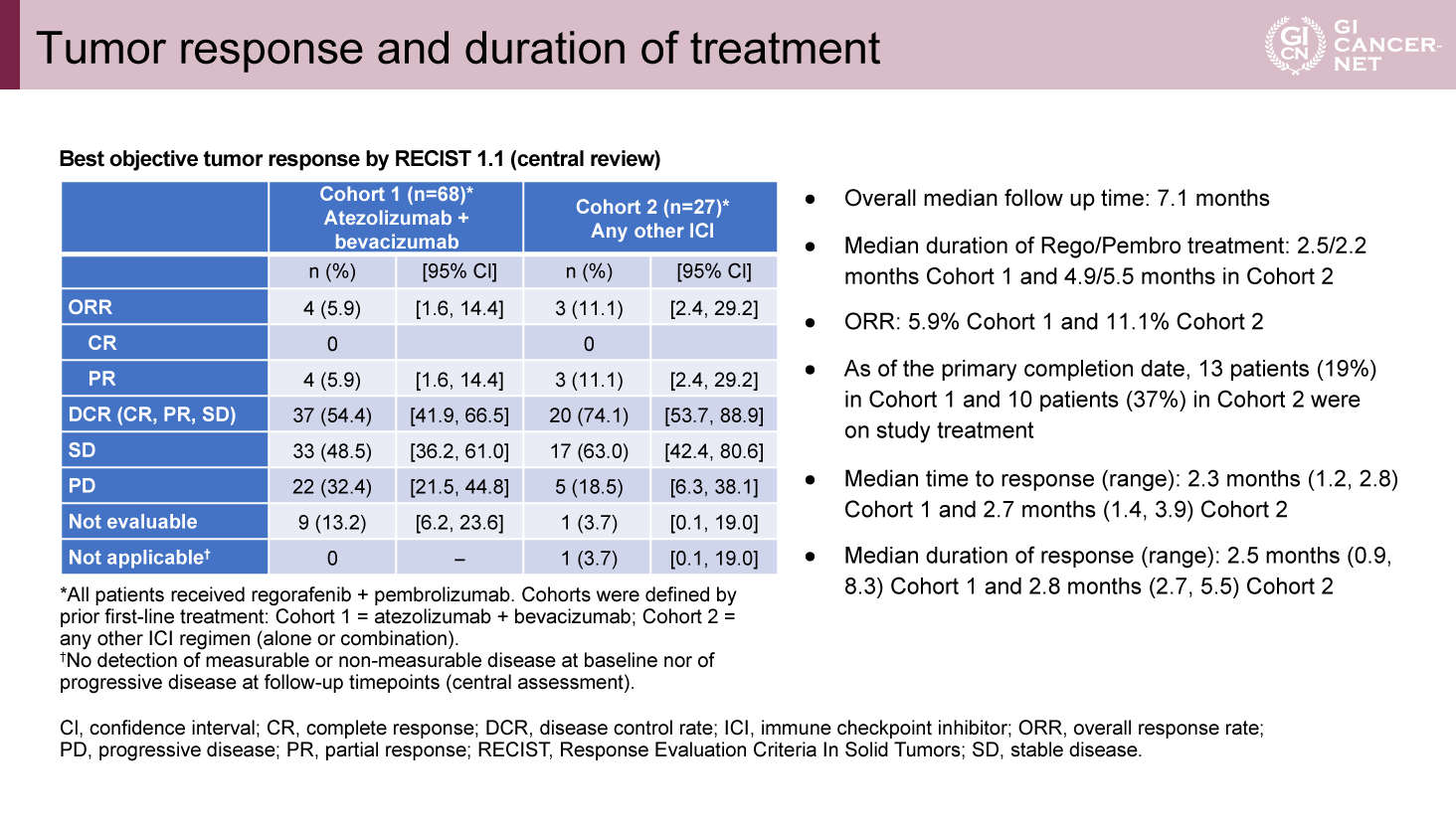
図2 Cross-trial comparison suggests that factors associated with resistance to ICIs appear to be upregulated as baseline in HCC patients who received prior ICI but not in ICI-naïve(発表者の許可を得て掲載)
結論
免疫チェックポイント阻害薬治療後の2次治療としてRegorafenib+Pembrolizumabの有効性は限定的であった。本試験結果自体はネガティブであり今後の臨床に影響を及ぼさないものの、免疫チェックポイント阻害薬治療後に有効性が期待されていた、チロシンキナーゼ阻害薬+免疫チェックポイント阻害薬の組み合わせのORRやDORがかなり悪かったことは興味深いと考えられる。本ASCOではCheckMate 9DW試験によりNivolumab+Ipilimumabの有効性も示されており、今後さらに2次治療選択やシークエンスの議論が加速していくものと考えられるため、標準治療の確立や使い分けについては引き続き検討が必要である。
(レポート:静岡県立静岡がんセンター 消化器内科 大場 彬博)
関連サイト
・IMbrave150試験[ClinicalTrials.gov]
・HIMALAYA試験[ClinicalTrials.gov]
寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授