SPOTLIGHT試験の最終OS報告:CLDN18.2陽性、HER2陰性の切除不能局所進行または転移性胃・食道胃接合部腺癌に対する1次治療としてのmFOLFOX6+Zolbetuximab療法を検証した第III相試験
Final overall survival results from phase 3 SPOTLIGHT study evaluating zolbetuximab + mFOLFOX6 as first-line treatment for patients with claudin 18 isoform 2 (CLDN18.2)+, HER2-, locally advanced unresectable or metastatic gastric or gastroesophageal junction adenocarcinoma
Kohei Shitara, et al.
監修コメント
SPOTLIGHT試験の結果は2023年にLancetで報告され1)、mFOLFOX6にZolbetuximab(ZOL)を上乗せすることによりPFSおよびOSが延長することが示されている。本邦では、GLOW試験2)の結果と合わせて2024年3月に薬事承認され、6月から臨床現場で使用可能となった。今回は、SPOTLIGHT試験の最終OS解析の結果が報告された。
観察期間を延ばしてもPFSおよびOSの有意差が維持されており、mFOLFOX6にZOLを上乗せする効果のエビデンスがより強いものとなった。今回の解析では、毒性などにより早期に治療終了となってしまった患者を除外したPPSコホートでの解析結果が興味深い。
全体症例の解析に比べて、早期の時期からZOL群のK-M曲線が離れることと良好なHRが確認された。ZOLを継続的に使用できた症例では、その上乗せ効果がしっかり得られる可能性を示唆している。臨床上でZOL使用について懸念されているのは、導入早期の消化器毒性である。特に1-2コースに悪心・嘔吐が出現しQOLがあまり良くないことが報告されている。日本胃癌学会および日本癌治療学会からは、ZOLの制吐療法に関する制吐薬適正使用ガイドライン速報が出され、ZOL使用に関するマネジメントが提案されている。また、ZOLは奏効率の上乗せ効果が乏しいことが報告されているが、ZOL併用レジメンにおいてCR/PRの奏効が得られた集団では、生存期間が長い可能性が示された。
今回のPPSの結果から、うまくZOLを使用して継続して使用することができれば、薬剤の効果をより得られることが期待できるため、臨床で使用する際の消化器毒性対策がとても重要なものとなるであろう。
(聖マリアンナ医科大学 臨床腫瘍学講座 主任教授 砂川 優)
CLDN18.2陽性、HER2陰性胃癌・食道胃接合部癌の新たな1次治療
HER2陰性、切除不能局所進行もしくは転移性胃・食道胃接合部腺癌に対する1次化学療法は、CheckMate 649試験、ATTRACTION-4試験の結果からmFOLFOX6/CapeOX/SOX+Nivolumab療法が標準治療のひとつである。
Claudin-18 isoform 2(CLDN18.2)は細胞間接着結合分子であり、正常では胃粘膜上皮にのみ発現し、胃癌、食道胃接合部癌においても多くの場合その発現が保たれる。
正常胃細胞が悪性化すると細胞極性が失われ、CLDN18.2が細胞表面に現れるため、薬剤がアクセスしやすくなると言われている。
ZolbetuximabはCLDN18.2を標的とするキメラ化IgG1型モノクローナル抗体であり、CLDN18.2と結合して抗体依存性細胞障害(ADCC)と補体依存性細胞障害(CDC)を誘導することで抗腫瘍効果を示す薬剤である。第II相FAST試験にて、Zolbetuximabと化学療法の併用により、化学療法単独よりもPFSとOSが延長することが示された。
本試験は、CLDN18.2陽性、HER2陰性の切除不能局所進行または転移性胃・食道胃接合部腺癌に対するmFOLFOX6+Zolbetuximab療法の効果を検証する、国際多施設共同無作為化二重盲検比較第III相試験である。本試験の主要評価項目であるPFS、副次評価項目であるOSの結果は2023年の米国臨床腫瘍学会-消化器癌シンポジウムで初めて報告され、その後Lancetで発表された。Zolbetuximab群はプラセボ群と比較し、OS、PFSどちらも有意に良好であった。その後2024年3月に本邦でも承認され、6月より臨床実装が可能な状況である。
今回の米国臨床腫瘍学会ではSPOTLIGHT試験の最終OSが報告された。
mFOLFOX6療法に対するZolbetuximab上乗せの優越性を検証
主な適格基準は、1)化学療法施行歴のない切除不能局所進行または転移性胃・食道胃接合部腺癌、2)CLDN18.2陽性(組織免疫染色で75%以上が強陽性)、3)HER2陰性、4)ECOG PS 0-1であった。層別化因子は地域(アジアまたはそれ以外)、転移臓器数、胃切除歴の有無であった。
患者は無作為化され、mFOLFOX6+Zolbetuximab群とmFOLFOX6+プラセボ群に1:1で割り付けられた。Zolbetuximab群は、mFOLFOX6療法(2週毎)に加えてZolbetuximab初回loading doseとして800mg/m2、その後3週毎に600mg/m2を投与された。プラセボ群はmFOLFOX6+プラセボ療法を繰り返した。ZolbetuximabまたはプラセボはPDと判断されるまで投与され、mFOLFOX6は中止基準に当てはまるかPDになるまで、評価者の裁量で継続された。主要評価項目はPFSであり、PFSが有意な結果であった場合に副次評価項目であるOSを評価するようにデザインされた。その他の評価項目はORRと安全性であった。ad-hoc分析として、事前に定義されたper-protocol setのPFS、OSの分析を行った(PPS解析)。per-protocol setは試験治療を受けなかった患者、試験薬への曝露が十分でなかった患者、または画像評価を受けなかった患者を除外したものと定義された。またCR/PR症例におけるPDまでの期間を2群で比較した。
ZolbetuximabはITT解析、PPS解析のどちらにおいても有意にPFS、OSを改善した
565症例が登録され、Zolbetuximab群(283例)とプラセボ群(282例)に割り付けられた。PFSの追跡期間中央値はそれぞれ18.04ヵ月 vs. 17.91ヵ月(Zolbetuximab vs. プラセボ)、OS追跡期間中央値は33.28ヵ月 vs. 31.38ヵ月であった。
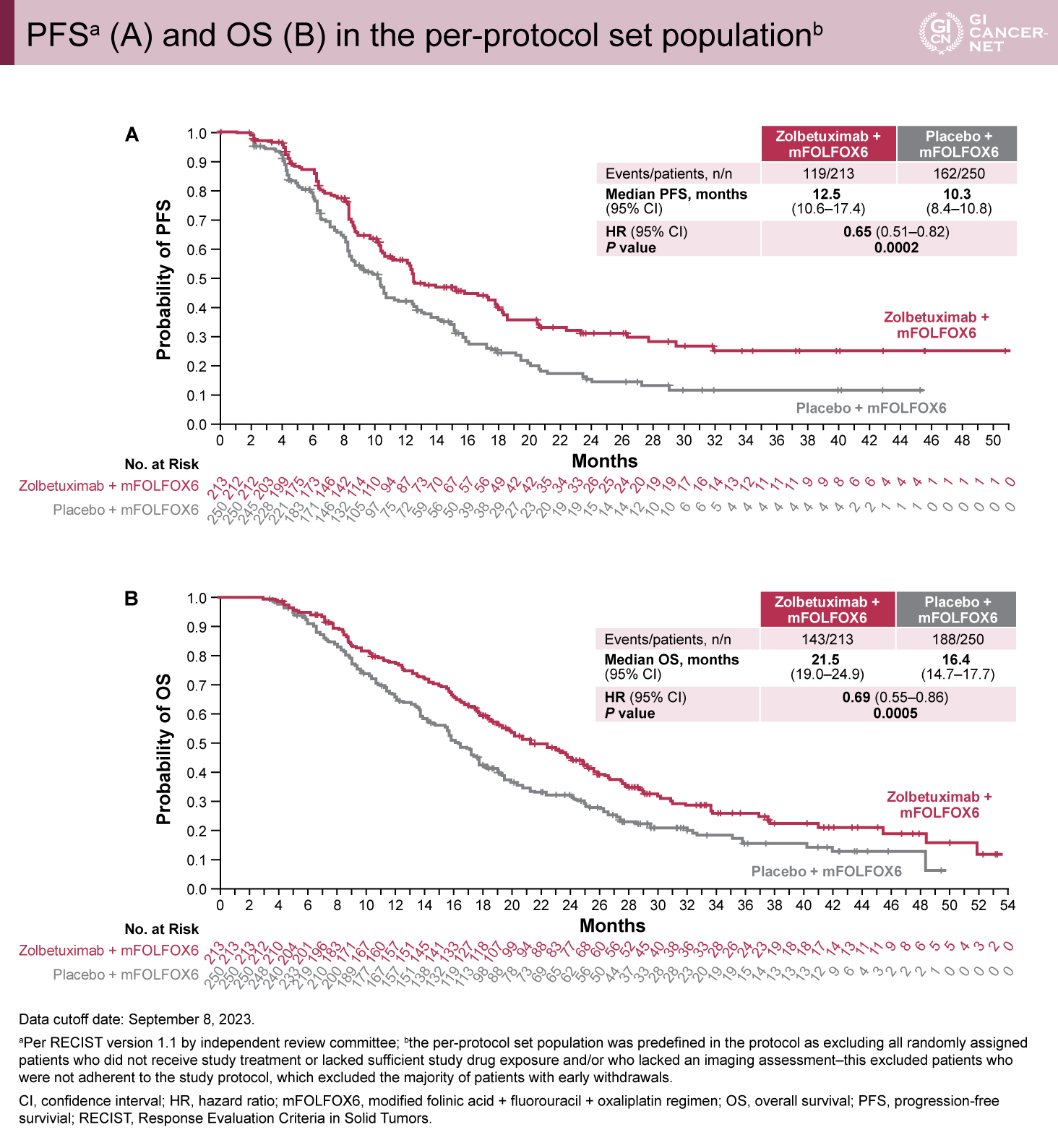
主要評価項目であるPFSはZolbetuximab群で有意に良好であった(ITT解析中央値:11.04ヵ月 vs. 8.94ヵ月、HR=0.734、95%信頼区間[CI]0.591-0.910、p=0.0024;PPS解析:12.52ヵ月 vs. 10.28ヵ月、HR=0.645、95% CI: 0.506-0.823、p=0.0002)(図1A、図2A)。OSもZolbetuximab群で有意に良好な結果であった(ITT解析中央値:18.23ヵ月 vs. 15.57ヵ月、HR=0.784、95% CI: 0.644-0.954、p=0.0075;PPS解析:21.49ヵ月 vs. 16.39ヵ月、HR=0.687、95% CI: 0.550-0.859、p=0.0005)(図1B、図2B)。PPS解析ではITT解析と比較してPFS、OS曲線が早期に乖離していた。
図1 PFSa,b (A) and OSc (B) in the full analysis setd(発表者の許可を得て掲載)
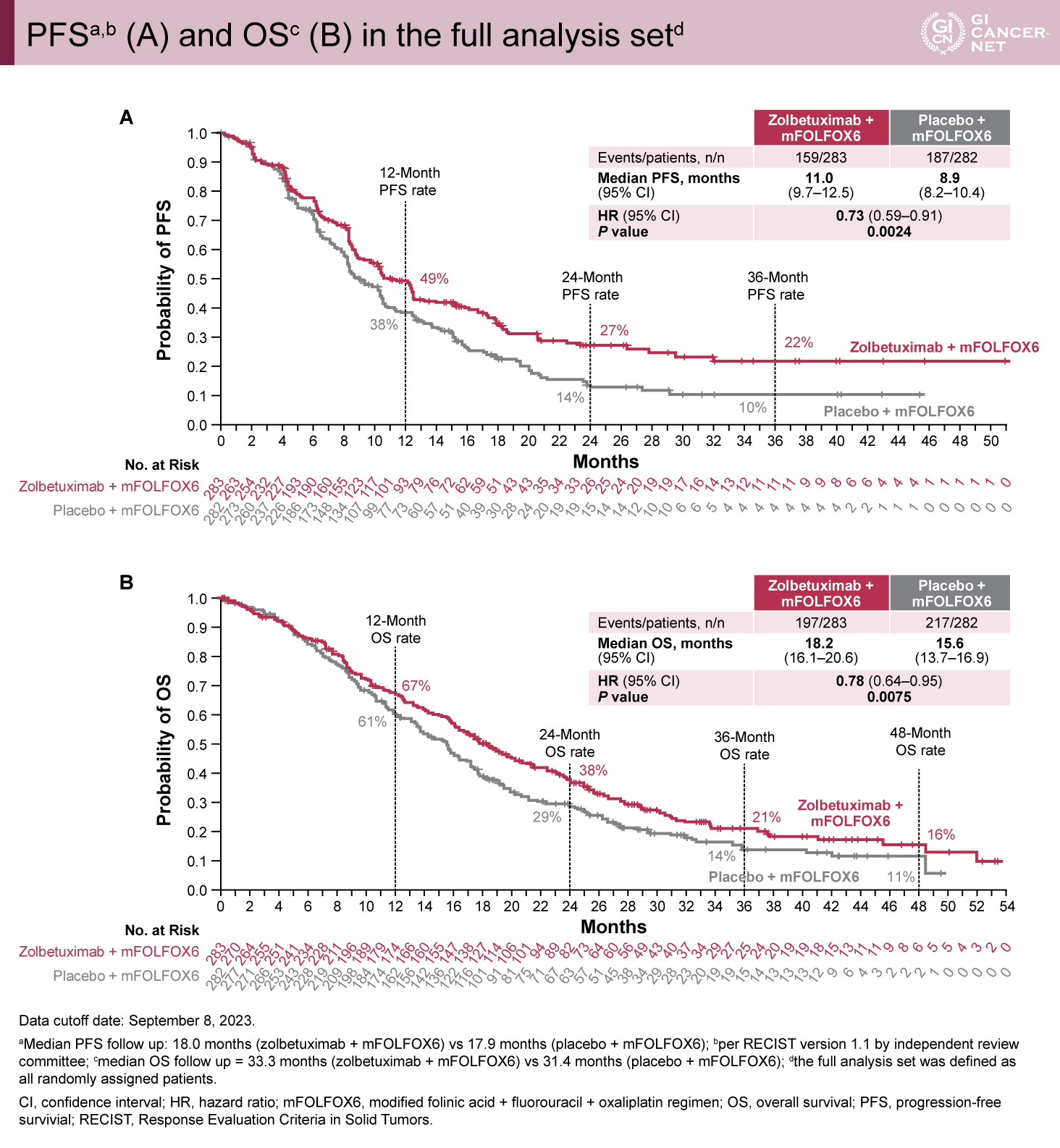
図2 PFSa (A) and OS (B) in the per-protocol set populationb(発表者の許可を得て掲載)
サブグループ解析では、食道胃接合部癌の場合のみPFS、OSハザード比が1を上回っていた(PFS:HR=1.05、OS:HR=1.02)。CR/PR症例に限ると、Zolbetuximab群ではプラセボ群よりもPDまでの期間が長かったが(ITT解析中央値:15.28ヵ月 vs. 14.92ヵ月、HR=0.760、95% CI: 0.507-1.140、p=0.0930)、一方で測定可能病変を有する症例のORRは各群で同様であった(ITT解析中央値:61.1%[95% CI: 54.20-67.75]vs. 62.4%[55.45-68.95])。安全性プロファイルは嘔気(grade≧3:16.1%)、嘔吐(grade≧3:16.1%)がプラセボ群と比較して多かった。安全性は既報と変化がなかった。
まとめ
mFOLFOX6+Zolbetuximab療法は、mFOLFOX6療法と比較してPFS、OSを有意に改善し、最終解析でも新たな毒性はみられなかった。ITT解析と比較して、早期離脱患者の大部分を排除した集団であるPPS解析ではPFS、OS曲線が早期に乖離した。本治療はCLDN18.2陽性、HER2陰性の切除不能局所進行または転移性胃・食道胃接合部腺癌に対して1次治療の選択肢となる。
(レポート:聖マリアンナ医科大学 臨床腫瘍学講座 小川 和起)
References
1) Shitara K, et al.: Lancet. 401(10389): 1655-1668, 2023 [PubMed]
2) Shah MA, et al.: Nat Med. 29(8): 2133-2141, 2023 [PubMed]
関連サイト
・SPOTLIGHT試験[ClinicalTrials.gov][論文紹介]
・GLOW試験[ClinicalTrials.gov][論文紹介]
砂川 優先生
聖マリアンナ医科大学 臨床腫瘍学講座 主任教授