切除可能な食道腺癌において周術期化学療法(FLOTレジメン)と術前化学放射線療法(CROSSレジメン)を比較するランダム化第III相ESOPEC試験(NCT02509286)
Perioperative Chemotherapy (FLOT) versus Neoadjuvant Chemoradiotherapy (CROSS) for Resectable Esophageal Adenocarcinoma: The ESOPEC Trial (NCT02509286)
Jens Hoeppner, et al.
監修コメント
CROSS試験は、2012年にオランダの研究グループが発表したもので、食道扁平上皮癌、食道腺癌、食道胃接合部腺癌を対象に、手術単独群に対し、PaclitaxelとCarboplatinを併用し、さらに放射線療法を併用することで、有意に生存期間を延長した試験である1)。欧米、主に欧州では、以前より胃癌に対しては術前と術後に化学療法を行う戦略がとられており、MAGIC試験により、術前術後のECF(Epirubicin+5-FU+Cisplatin)療法が確立されていたが、2019年にドイツの研究グループが発表したFLOT4試験の結果、ECFに対してFLOT療法が生存期間を延長した2)。食道癌および食道胃接合部癌は、胃癌に比べて周辺臓器に近く、進行癌の場合切除が困難な場合が多い。強力な化学療法がない時代は、確実に腫瘍を縮小し、治癒可能な唯一の治療である手術に結びつけるために、放射線治療が選ばれていた。しかし、CROSS試験の10年フォローアップのデータやNeoRes試験3)の結果、放射線治療は、局所再発は抑えるが、遠隔転移再発は抑えない上、術後の他病死を増やすなど、デメリットもわかってきた。そこで、食道腺癌、食道胃接合部腺癌に対して、従来の標準治療であり、2剤+局所治療であるCROSSレジメンに対し、3剤併用全身化学療法であるFLOT療法の比較が行われた。先行して、Neo-AEGIS試験という、CROSS試験とMAGICレジメン(ECFなど)を比較した試験では、両群に差を認めなかった4)。純粋にMAGICに勝ったFLOTと、引き分けたCROSSを比較すれば、FLOTが上回るであろうと予想していたところ、結果としてその通りになったというのが、ESOPEC試験の結果である。
しかし、いくつかの注意点が必要である。CROSSレジメンは、免疫チェックポイント阻害剤の登場により、CheckMate 577試験が行われ、術前CRT後に手術を行い、病理学的完全奏効が得られなかった集団に、術後Nivolumabを1年行うことで、生存のデータはないものの、再発を抑える5)として、すでに日常診療でも用いられている。ESOPEC試験では、CROSSレジメンの術後にNivolumabは入っておらず、その分現在の日常診療よりも劣る治療がなされていると思われる。また、通常術前CRTと、術前化学療法との比較では、pCR割合はCRTが勝るが、遠隔成績は劣るということが多かった6)が、今回のCROSS群のpCRは10%と、CROSS試験の23%を下回っており、また、標準治療であるはずのCROSSレジメンの治療完遂割合は67%と非常に低かった。また、死亡の内訳についても原病死、他病死の割合などは今回の発表では示されていない。
日本では、食道腺癌、食道胃接合部腺癌は胃癌に準じて治療が行われており、現在の標準治療は手術先行および術後化学療法であるが、現在JCOG2203試験7)として術前FLOTあるいは術前DOS療法の優越性をみる試験が行われている。食道扁平上皮癌に対しては、JCOG1109試験において、術前2剤化学療法に対して、術前DCF療法が優越性を示したが、術前2剤+放射線治療が優越性を示さなかった8)ことで、術前に放射線を行うという選択肢はない。なので、ESOPEC試験で日本の標準治療が変わることはない。次のステップである、免疫チェックポイント阻害剤との併用では、術前化学放射線療法はあまりよい結果が報告されておらず、そういった意味でも、胃癌、食道癌の周術期治療は、FLOTあるいはDCF療法といった3剤併用化学療法にさらに何を加えるのか、という流れがさらに続くと思われる。すでに胃癌に対して術前術後FLOTにPembrolizumabを併用したKEYNOTE-585試験9)や、Durvalumabを併用するMATTERHORN試験などが行われており、さらなる強力な全身化学療法が、この領域で検討されることになると思われた。
(国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長 加藤 健)
食道腺癌における術前術後化学療法と術前化学放射線療法の優劣は定まっていない
食道腺癌において、主に胃癌に対して用いられてきた術前術後化学療法と、食道癌においてエビデンスが確立された、術前化学放射線療法のいずれも標準治療ではあるが、術前術後化学療法(FLOT)と術前化学放射線療法(CROSS)のどちらが優れているかは不明なままであり、FLOTとCROSSの有効性および安全性を比較する。
局所進行食道腺癌における周術期化学療法と術前化学放射線療法を比較したランダム化第III相試験
本試験はドイツ国内の25施設で行われたランダム化第III相試験であり、術前術後化学療法群(FLOT群)と術前化学放射線療法群(CROSS群)に1:1に割り付けられた。TNM第7版によるステージングが用いられcT1N+またはcT2-4a, cN0/+, cM0の食道腺癌のみが対象となった。主要評価項目は全生存期間(OS)で副次評価項目として無増悪生存割合(PFS)、術後病理学的ステージ、術後合併症、有害事象、無再発生存期間、局所再発、QOLとした。術前術後化学療法群は術前後にFLOTレジメン(5-FU+Leucovorin+Oxaliplatin+Docetaxel、2週間ごと、4サイクル)が用いられ、術前化学放射線療法群はCROSSレジメン(Paclitaxel+Carboplatin、毎週、5サイクルとRT:41.4Gy/23Fr)が用いられた。
切除可能な食道腺癌において、FLOTはCROSSに対して全生存期間を延長した
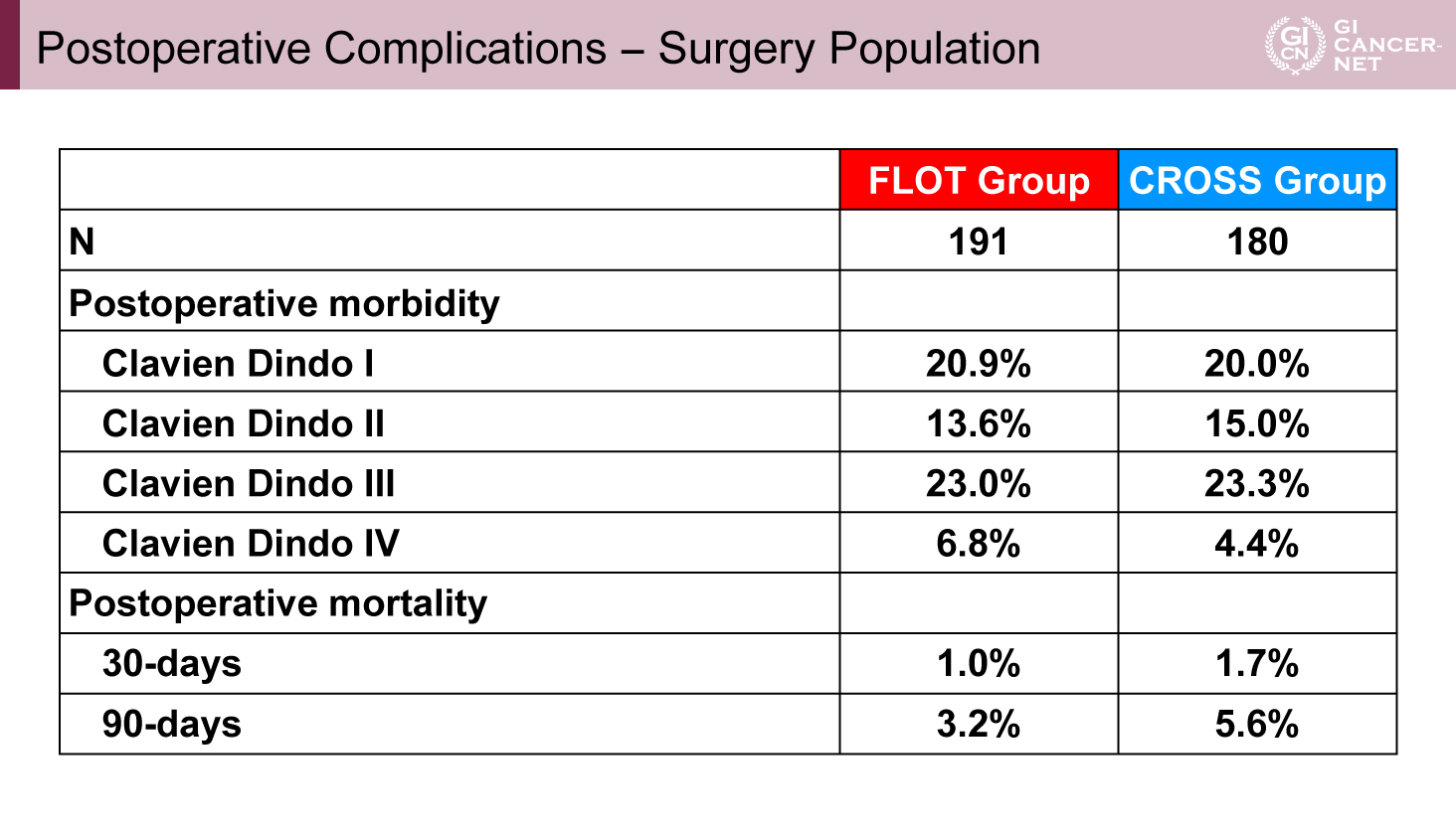
438例が登録され、FLOT群が221例、CROSS群が217例であった。年齢・性別・PS、ステージの背景は両群で偏りはみられなかった。Per-protocol集団(PP集団)はFLOT群93.7%、CROSS群90.3%であった。術前治療完遂割合はFLOT群で87.3%、CROSS群で67.7%であった。手術はそれぞれ86%、82.9%で施行されており、FLOT群において術後補助療法を完遂できたのは52.5%であった。ITT集団におけるOS中央値、3年生存期間割合(3y-OS rate)、5年生存期間割合(5y-OS rate)はFLOT群とCROSS群で66ヵ月 vs. 37ヵ月(HR=0.70[95% CI: 0.53-0.92]、p=0.012)、57.4% vs. 50.7%、50.6% vs. 38.7%であった(図1)。PP集団におけるOS中央値、3y-OS rate、5y-OS rateはFLOT群とCROSS群で66ヵ月 vs. 39ヵ月(HR=0.72[95% CI: 0.54-0.96]、p=0.023)、58.1% vs. 52.6%、51.8% vs. 40.5%であった(図2)。ITT集団におけるPFS中央値、3年無増悪生存期間割合、5年無増悪生存期間割合はFLOT群とCROSS群で38ヵ月 vs. 16ヵ月(HR=0.66[95% CI: 0.51-0.85]、p=0.001)、51.6% vs. 35.0%、44.4% vs. 30.9%であった。病理学的完全奏効割合はFLOT群とCROSS群でそれぞれ16.8% vs. 10.0%であった。Clavien-Dindo 3≦の割合はFLOT群とCROSS群でそれぞれ29.8% vs. 27.7%であった(表1)。術後30日死亡率はFLOT群とCROSS群でそれぞれ1.0% vs. 1.7%、また術後90日死亡率はFLOT群とCROSS群でそれぞれ3.2% vs. 5.6%であった。
図1 Overall Survival - ITT Population(発表者の許可を得て掲載)
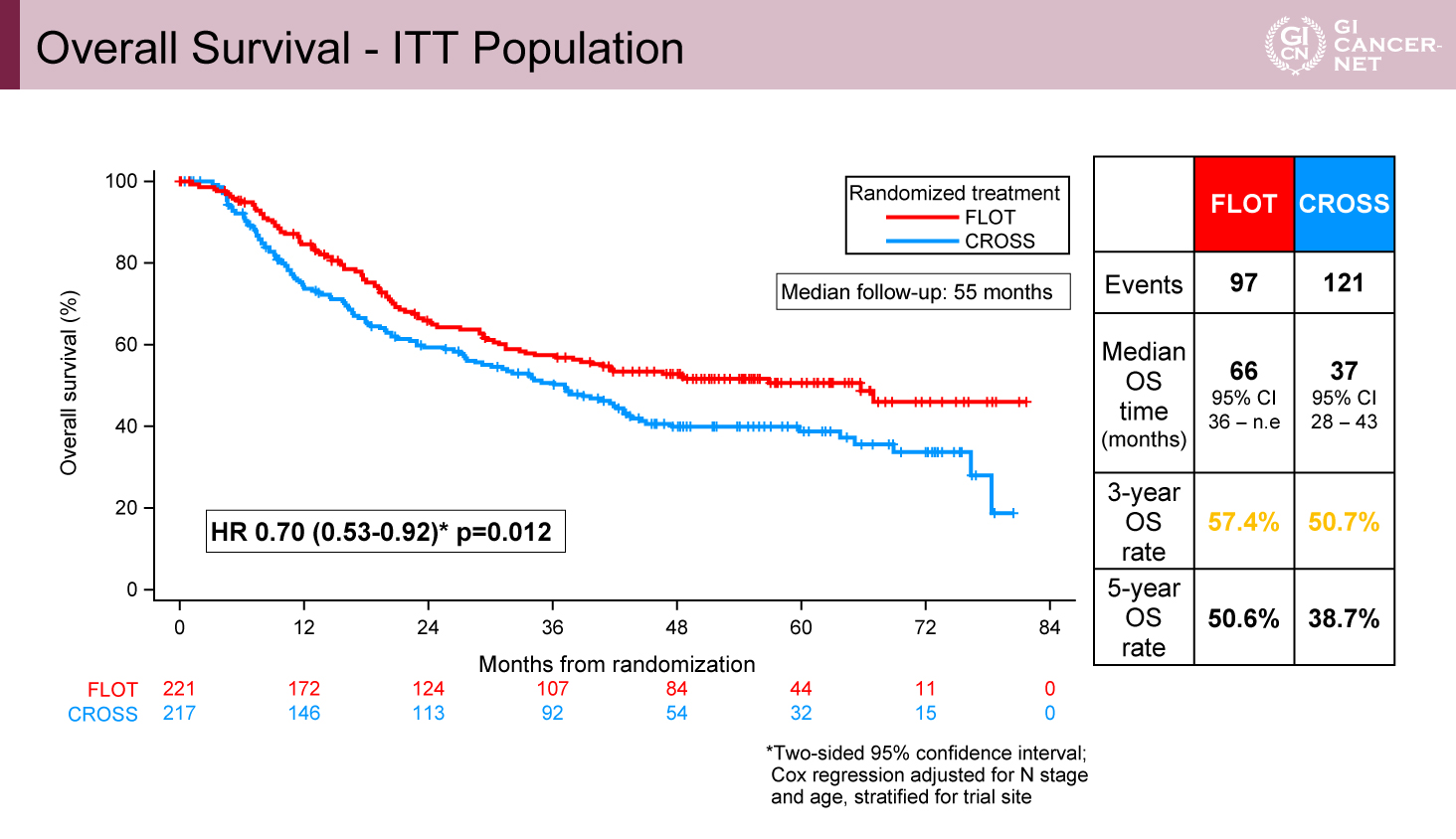
図2 Overall Survival - PP Population(発表者の許可を得て掲載)
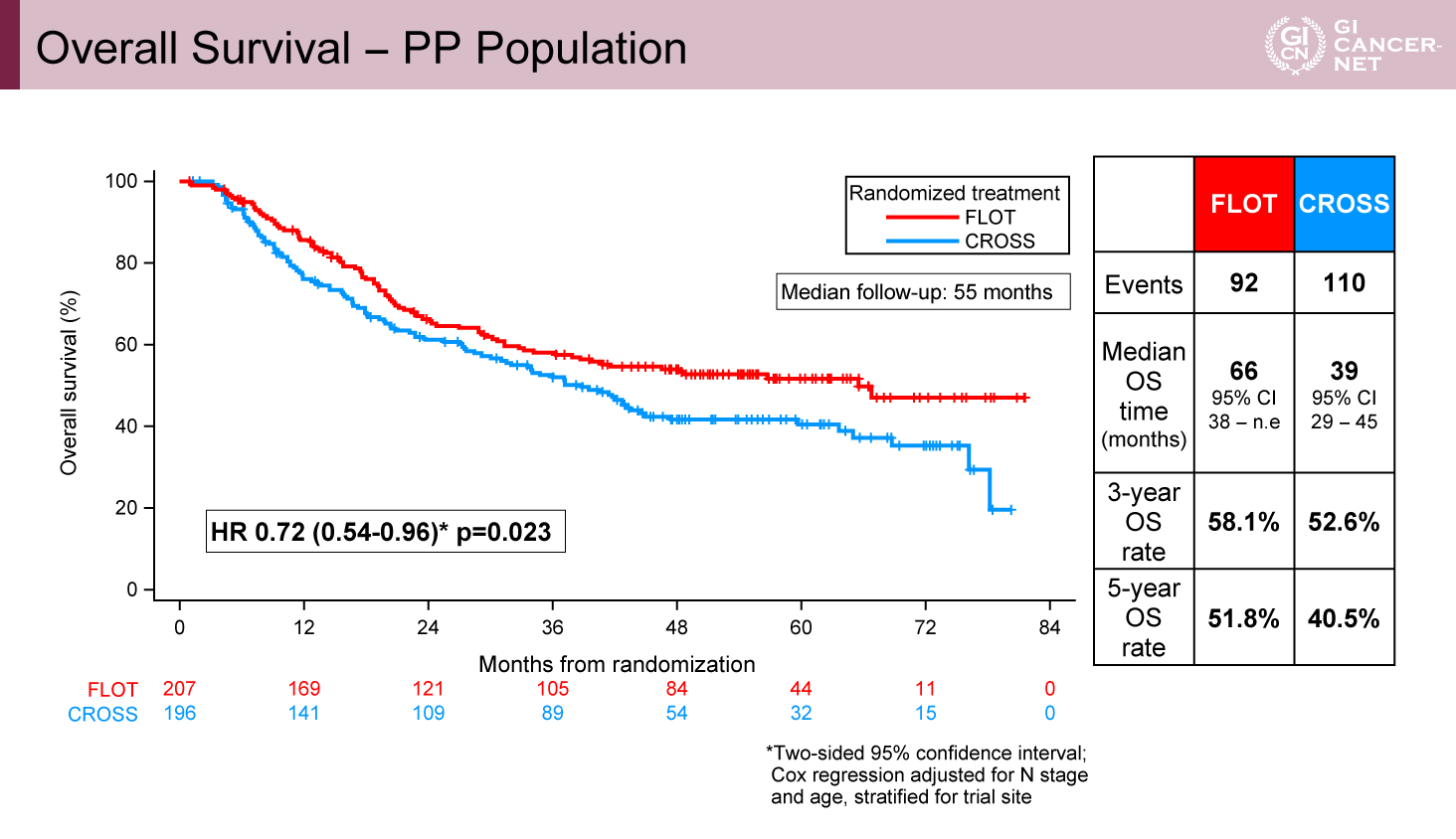
表1 Postoperative Complications - Surgery Population(発表者の許可を得て掲載)
まとめ
FLOTはCROSSと比較して全生存期間を改善する。切除可能食道腺癌に関してはCROSSよりFLOTのほうが好ましい可能性が示唆された。
(レポート:国立がん研究センター中央病院 頭頸部・食道内科 白石 和寛)
References
1) van Hagen P, et al.: N Engl J Med. 366(22): 2074-2084, 2012 [PubMed]
2) Klevebro F, et al.: Ann Oncol. 27(4): 660-667, 2016 [PubMed]
3) Al-Batran SE, et al.: Lancet. 393(10184): 1948-1957, 2019 [PubMed]
4) Reynolds JV, et al.: Lancet Gastroenterol Hepatol. 8(11): 1015-1027, 2023 [PubMed]
5) Kelly RJ, et al.: N Engl J Med. 384(13): 1191-1203, 2021 [PubMed]
6) Tang H, et al.: Ann Oncol. 34(2): 163-172, 2023 [PubMed]
7) Kita R, et al.: Jpn J Clin Oncol. 54(2): 206-211, 2024 [PubMed]
8) Kato K, et al.: Lancet. Jun 11, 2024 [Online ahead of print] [PubMed]
9) Shitara K, et al.: Lancet Oncol. 25(2): 212-224, 2024 [PubMed]
関連サイト
・ESOPEC試験[ClinicalTrials.gov]
加藤 健先生
国立がん研究センター中央病院 消化管内科/頭頸部・食道内科 科長