小さな大腸癌肝転移を有する患者に対する肝切除とアブレーションを比較した国際多施設共同ランダム化比較第III相試験(COLLISION試験)
Colorectal liver metastases: surgery versus thermal ablation: final results of the international phase 3 randomized controlled COLLISION trial
Martijn R. Meijerink, et al.
監修コメント
日本では、切除可能な大腸癌肝転移に対する標準治療は肝切除とされ、「熱凝固療法は第一選択とはしない」ことが強く推奨されている。一方、NCCNやESMOのガイドラインでは、根治的治療が可能な場合、熱凝固療法単独あるいは肝切除との併用を考慮してよいとされている。欧米では、肝切除と比べて生存期間に差がないとする報告が増えてきた。
本試験(COLLISION試験)は、3cm以下の切除可能で熱凝固療法可能な病変を有する肝限局転移の大腸癌患者を対象に、肝切除と熱凝固療法を比較する、初の大規模ランダム化試験である。熱凝固療法適応外の病変は肝切除と組み合わせる、診断の中央判定が行われるなど、十分に質が担保された臨床試験であった。結果、熱凝固療法は、安全で低侵襲であり、局所制御や長期予後は肝切除に劣らないことが示された。ただし、約60%が低腫瘍量(3cm以下の病変が3個以内)と、比較的腫瘍量が少ない集団における検証であった点に注意が必要である。また、サブグループ解析(OS)では、薬物療法の前治療歴ありの患者群でHR 1.26と有意差はないものの熱凝固療法群が不良である。化学療法後に25mm未満に縮小した病変へのRFAの局所再発率は高いという既報もあることから、本試験の実地診療への外挿の際には留意したい。本試験は中間解析で中止された途中経過であり、今後の長期観察結果報告も重要である。しかし、日本でも熟練した施設で適切な患者を選べば、熱凝固療法は有力な治療オプションとなると考えられる。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
大腸癌肝転移に対するアブレーションの治療成績は向上している
切除可能な大腸癌肝転移(CRLM)に対する標準治療は肝切除であり、解剖学的に切除不能例、合併症により手術適応とならない症例に対してアブレーションが推奨されている。一方で、デバイスや画像解析能の進歩によりアブレーションの治療成績は向上しており、近年のシステマティックレビューやメタアナリシスでは、アブレーションのほうが安全かつ低侵襲で、局所制御能や全生存期間も肝切除に匹敵すると報告されている1,2)。ただし、切除可能性の基準が統一されていないため、これらの検討には選択バイアスが存在する可能性があり、CRLMを有する大腸癌患者に対して肝切除とアブレーションを比較する前向き試験の必要性が指摘されていた。
3cm以下の大腸癌肝限局転移を有する患者において、アブレーションの肝切除に対するOS非劣性を検証
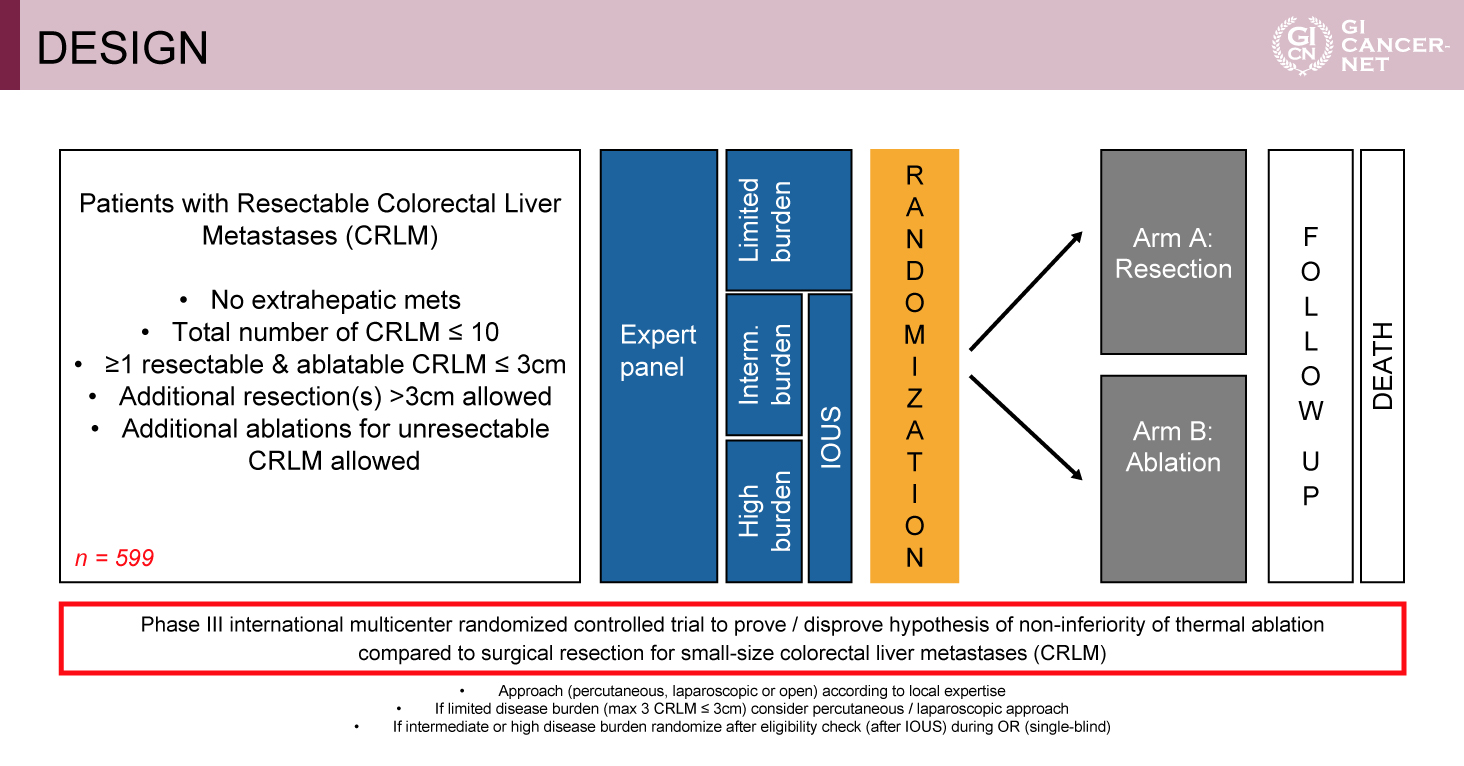
本試験は、オランダを中心に実施された、3cm以下の切除可能CRLMに対する肝切除とアブレーションを比較した国際多施設共同、単盲検のランダム化比較第III相試験である(図1)。主な適格基準は、年齢18歳以上、ECOG PS 0-2、切除可能かつアブレーション可能な3cm以下の肝転移を少なくとも1つ以上有する、その他の肝転移はサイズにかかわらず切除可能もしくは3cm以下でアブレーション可能、肝転移個数が10個以下、肝外転移がない、肝転移に対する切除歴またはアブレーション歴がない、等であった。
肝転移の切除可能性およびアブレーションの適応性は、少なくとも2名の放射線科診断医、2名の放射線科治療医、2名の肝臓外科/腫瘍外科医により構成されたエキスパートパネルにおいて検討された。切除可能かつアブレーション可能の病変は割付された治療を施行する標的病変、他の病変は切除適応あるいはアブレーション適応病変と設定され、適格例は低腫瘍量/中等度腫瘍量/高腫瘍量群に分類された。中等度および高腫瘍量群においては、術中超音波検査を施行して適格性を確認したのちにランダム化が行われ、肝切除群とアブレーション群に1:1に割り付けられた。
主要評価項目は全生存期間(OS)であり、肝切除群に対するアブレーション群の非劣性を検証することが本試験の主な目的であった。副次評価項目は、遠隔無増悪生存期間(DPFS)、局所無増悪生存期間(LTPFS)、局所制御率(LC)、安全性、入院日数などであった。
図1 DESIGN(発表者の許可を得て掲載)
腫瘍量の少ない症例が多く登録された
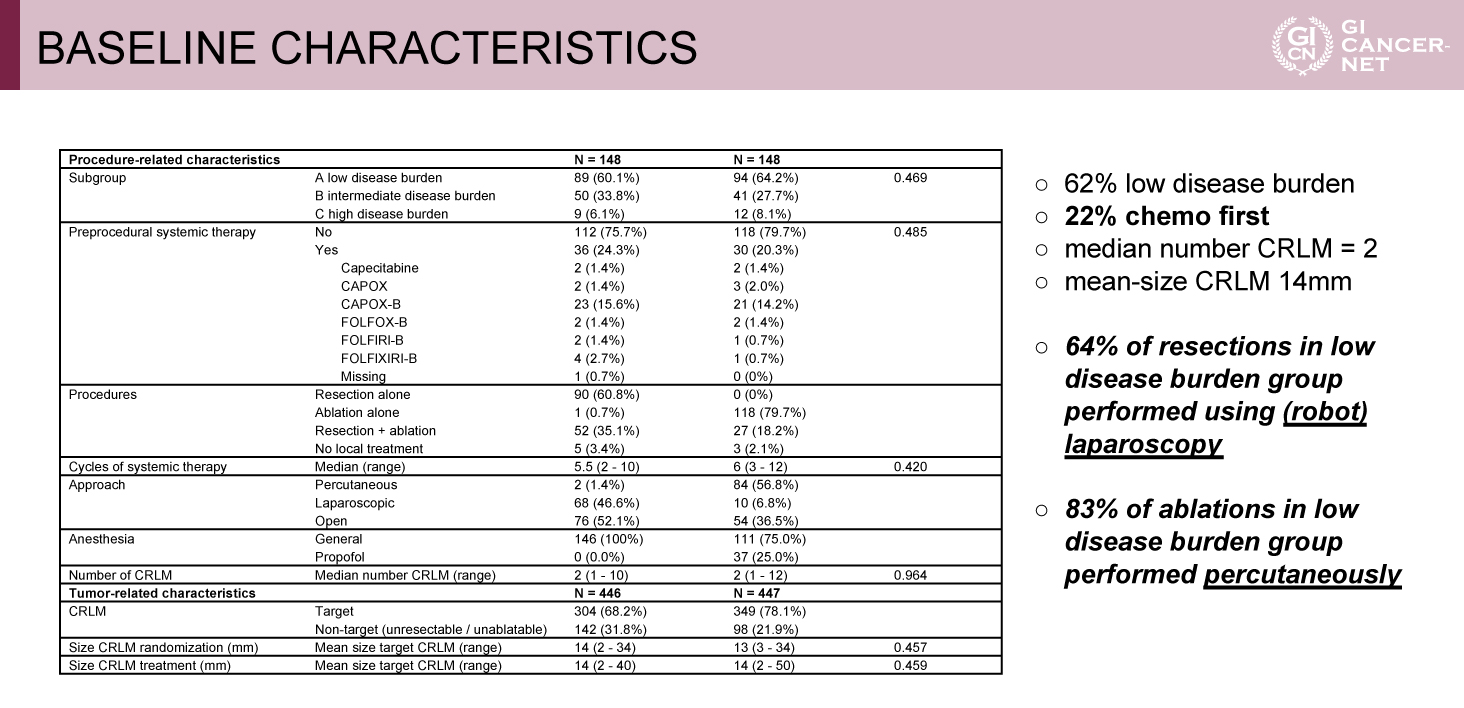
本試験は、中間解析の時点で肝切除群に対するアブレーション群のOS非劣性が証明される条件付き確率が91%となり、事前に設定されたstopping ruleを満たしたため有効中止となった。登録された342例のうち、登録後に脱落した42例を除いた300例がランダム化され、両群にそれぞれ148例ずつ割り付けられた。患者背景では両群間に偏りはなく、同時性肝転移49.3%、低腫瘍量群62%、化学療法先行22%、肝転移個数中央値2個、肝転移平均サイズ14mmと比較的腫瘍量の少ない症例が多く登録された。肝切除群の35.1%でアブレーションを併用、アブレーション群の18.2%で肝切除を併用された(表1、表2)。
表1 BASELINE CHARACTERISTICS(発表者の許可を得て掲載)
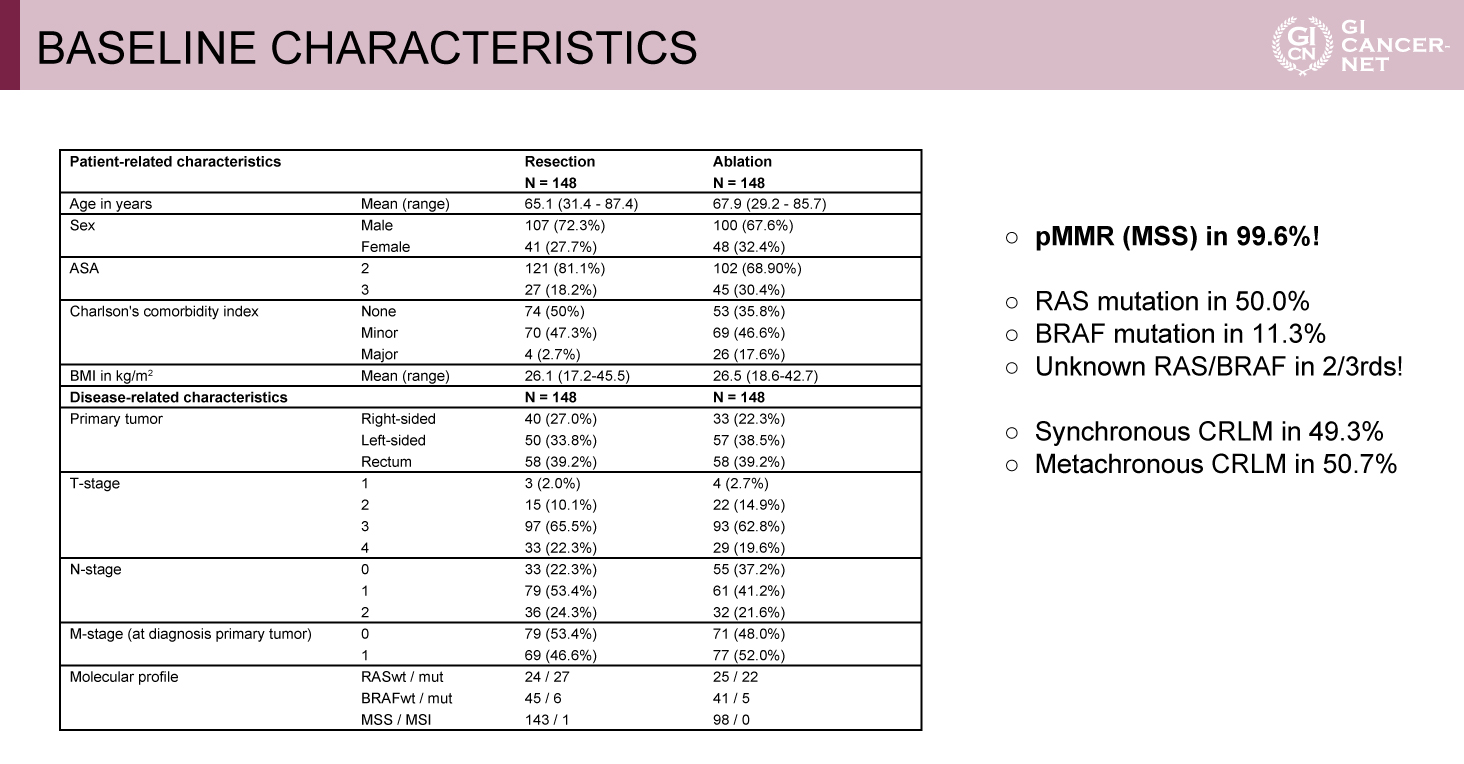
表2 BASELINE CHARACTERISTICS(発表者の許可を得て掲載)
アブレーションは肝切除よりも安全性が高く、生存期間が劣らないことが示された
主要評価項目であるOSにおいて、肝切除群に対するアブレーション群の非劣性が示された(HR=1.051、95%信頼区間[CI]0.695-1.590、p=0.813)(図2)。DPFSおよびLTPFSにおいても、両群間でそれぞれ有意差を認めなかった(HR=1.030、95% CI: 0.776-1.368、p=0.836;HR=0.817、95% CI: 0.435-1.4543、p=0.530)。標的病変に対するLC(治療後再発をきたした病変に対する再治療を含む)は、患者毎ではアブレーション群が良好な傾向を示し(HR=0.131、95% CI: 0.016-1.064、p=0.057)、病変毎ではアブレーション群が有意に良好であった(HR=0.092、95% CI: 0.011-0.735、p=0.024)。
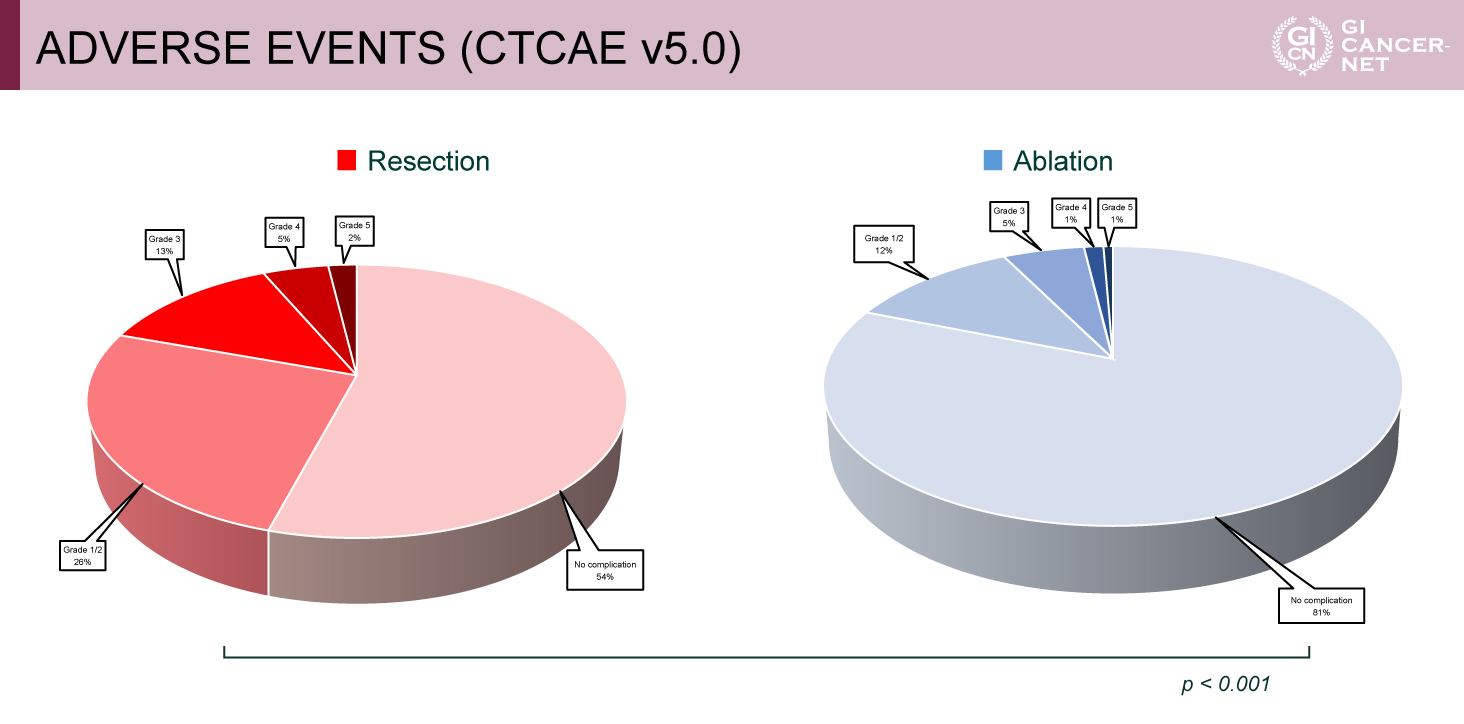
有害事象発現割合は、肝切除群46%、アブレーション群19%(grade 3以上は20% vs. 7%)であり、有意にアブレーション群で低かった(p<0.001)(図3)。治療関連死は肝切除群2.1%、アブレーション群0%であった。入院日数中央値は肝切除群4日(範囲1-36)、アブレーション群1日(範囲1-44)で、有意にアブレーション群で短かった(p<0.001)。
図2 OVERALL SURVIVAL - PRIMARY ENDPOING(発表者の許可を得て掲載)
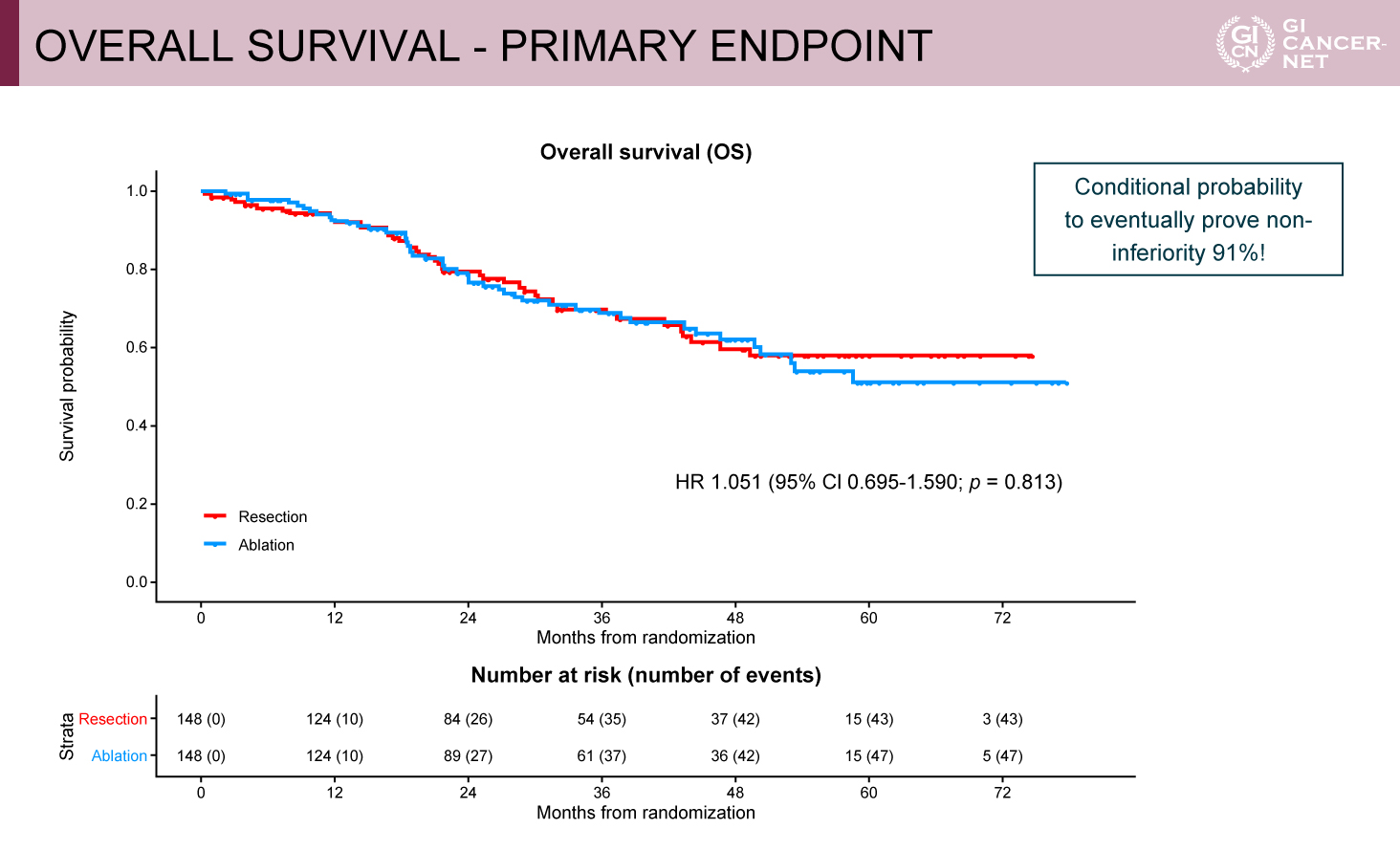
図3 ADVERSE EVENTS (CTCAE v5.0)(発表者の許可を得て掲載)
結論
3cm以下の肝限局転移を有する大腸癌患者に対するアブレーションは、肝切除と比較して治療関連死や有害事象が少なく、局所制御能は同程度で、生存期間が劣らないことが示された。特に腫瘍量の少ない症例においては、アブレーションは大腸癌肝転移に対する新たな標準治療の選択肢となりうる可能性が示唆された。
(レポート:愛知県がんセンター 薬物療法部 榊田 智喜)
References
1) Meijerink MR, et al.: Cardiovasc Intervent Radiol. 41(8): 1189-1204, 2018 [PubMed]
2) Puijk RS, et al.: Cardiovasc Intervent Radiol. 45(8): 1074-1089, 2022 [PubMed]
関連サイト
・COLLISION試験[ClinicalTrials.gov]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長