切除可能境界膵癌に対するGemcitabine+Nab-Paclitaxel療法とS-1併用化学放射線療法を比較する第II/III相試験(GABARNANCE試験)
Randomized phase II/III trial of gemcitabine plus nab-paclitaxel versus concurrent chemoradiotherapy with S-1 as neoadjuvant treatment for borderline resectable pancreatic cancer: GABARNANCE study
Masafumi Ikeda, et al.
監修コメント
本試験は、未治療の日本人膵癌患者のうち、切除可能性分類が切除可能境界である患者に限定して組み入れられ、術前化学療法と術前化学放射線療法との比較であった点、局所進行膵癌に対しても頻用され高い効果が期待されるGemcitabine+Nab-Paclitaxel療法とS-1併用化学放射線療法が採用された点など、実臨床のクリニカルクエスチョンが反映されたデザインであった。結果はレポートのごとく、主要評価項目に設定されたOSは、Gemcitabine+Nab-Paclitaxel療法に対するS-1併用化学放射線療法のハザード比が0.786(95%信頼区間0.489-1.265)と統計学的な有意差は認められなかったものの、中央値はそれぞれ23.1ヵ月と31.5ヵ月であり、Kaplan-Meier曲線の特に後半においてS-1併用化学放射線療法で良好な結果であった。
結果を解釈する際に、一部切除可能境界患者を含む局所進行膵癌を対象としたGemcitabine+Nab-Paclitaxel療法とFOLFIRINOX療法を比較したJCOG1407試験が参考になる。既に論文が公表されているが1)、Gemcitabine+Nab-Paclitaxel療法のPFS中央値は9.4ヵ月、OS中央値は21.3ヵ月であったと報告されており、これらは本試験のPFS、OSと一致する。もちろん異なる試験間の比較であるものの、一般的により予後不良とされる局所進行膵癌と同程度であったことは、今後、Gemcitabine+Nab-Paclitaxel療法の治療期間の妥当性や術前治療の効果に応じた切除の意義が論点となりうると考える。
また、化学放射線療法と化学療法の使い分けにおいて最も重要な点は画像で捉えられない微小な転移の有無と考えられる。膵癌切除後の再発様式は大きく、局所再発と遠隔転移臓器再発とに分けられ、本試験の化学放射線療法で用いられたS-1は、Gemcitabine+Nab-Paclitaxel療法と比較すると一般的に抗腫瘍効果は弱いと考えられる。したがって、微小な転移を有する症例では化学療法、腫瘍が局所にとどまる症例では化学放射線療法のような治療選択が有効と考えられる。今後、両群でどのような再発をきたしたのか、再発様式ごとの予後、再発予測因子の検討など、興味は尽きず、詳細な検討によってこれらの至適な使い分けが明らかにされることを期待したい。
(金沢大学 先進予防医学研究センター 特任准教授 寺島 健志)
切除可能境界膵癌に対する術前治療は推奨されているものの標準治療は定まっていない
切除可能境界膵癌は切除可能膵癌と切除不能進行膵癌の間に存在する概念で、解剖学的には主要血管との関係によって定義される。従前は切除可能膵癌と同様に外科的切除および術後補助化学療法が行われていたものの、術後の再発率が高く予後も不良な集団のため、国内外のガイドラインで術前治療(化学療法または化学放射線療法)が推奨されている。一方で、切除可能境界膵癌のみを対象とした大規模なランダム化比較試験はなく、その標準治療は定まっていない。切除可能膵癌と切除可能境界膵癌の両者を含む比較試験では、Prep-02試験で全体集団に対する術前化学療法の有効性が、PREOPANC試験で部分集団に対する術前化学放射線療法の有効性が示されているものの、切除可能境界膵癌は部分集団に過ぎないためそのエビデンスレベルは高くない。
国内では化学療法としては局所進行膵癌の標準治療に準じてGemcitabine+Nab-Paclitaxel療法またはFOLFIRINOX療法が行われることが多い。S-1併用化学放射線療法については切除可能境界膵癌のみを対象としたJASPAC05試験において、R0切除割合52%、OS中央値30.8ヵ月など良好な結果が示されていた2)。そのため、Gemcitabine+Nab-Paclitaxel療法とS-1併用化学放射線療法を比較する本試験が実施された。
画像中央診断で確認された切除可能境界膵癌のみを対象とした第II/III相試験
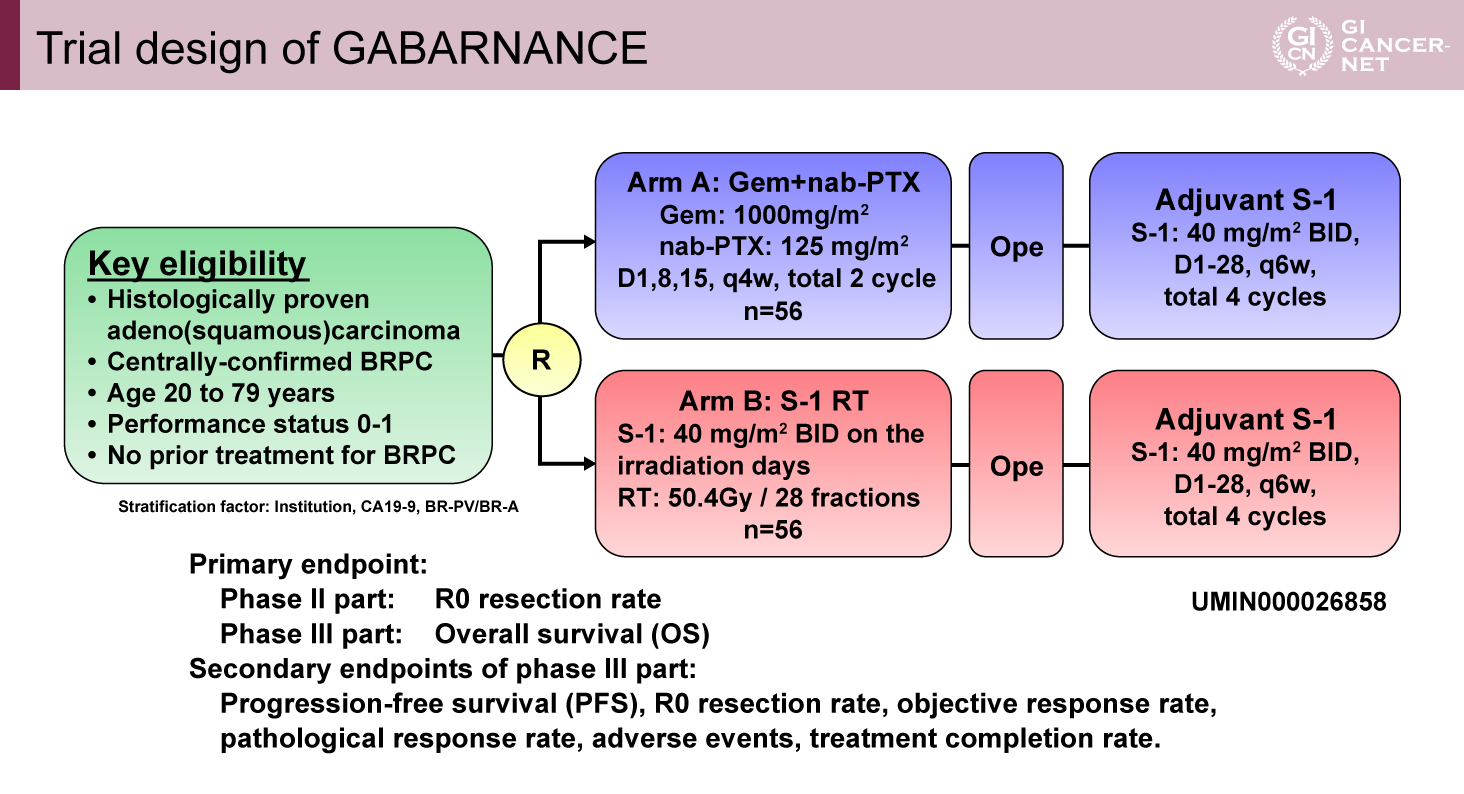
本邦の多施設によって行われたランダム化第II/III相試験(GABARNANCE試験)であり、対象は組織学的に確認された腺癌または腺扁平上皮癌で、79歳以下、PS 0または1、治療未施行の画像中央診断で確認された切除可能境界膵癌であった。
Gemcitabine+Nab-Paclitaxel療法(Gemcitabine 1,000mg/m2、Nab-Paclitaxel 125mg/m2、3投1休)またはS-1併用化学放射線療法(S-1 80mg/m2、照射日、RT 50.4Gy/28fr)に1:1にランダム化され、手術およびS-1による24週の術後補助化学療法が実施された(図1)。
第II相部分の主要評価項目はR0切除割合であり、第III相部分の主要評価項目はOSであった。副次評価項目としてはPFS、R0切除割合、ORR、病理学的奏効割合、有害事象、治療完遂割合が評価された。第III相部分の統計学的設定は、2年生存割合50%に対して17%の上乗せを検出(HR=0.58)することであり、両側α=0.1、検出力70%で110例の登録を要した。
図1 Trial design of GABARNANCE(発表者の許可を得て掲載)
両群に有意差はないもののOS中央値やKM曲線後半でS-1併用化学放射線療法が良好な傾向
最終的に112例(各群56例)がランダム化され、それぞれの治療を受けた。BR-PVの割合はGemcitabine+Nab-Paclitaxel療法群13%、S-1併用化学放射線療法群14%であり、大半はBR-Aであった。
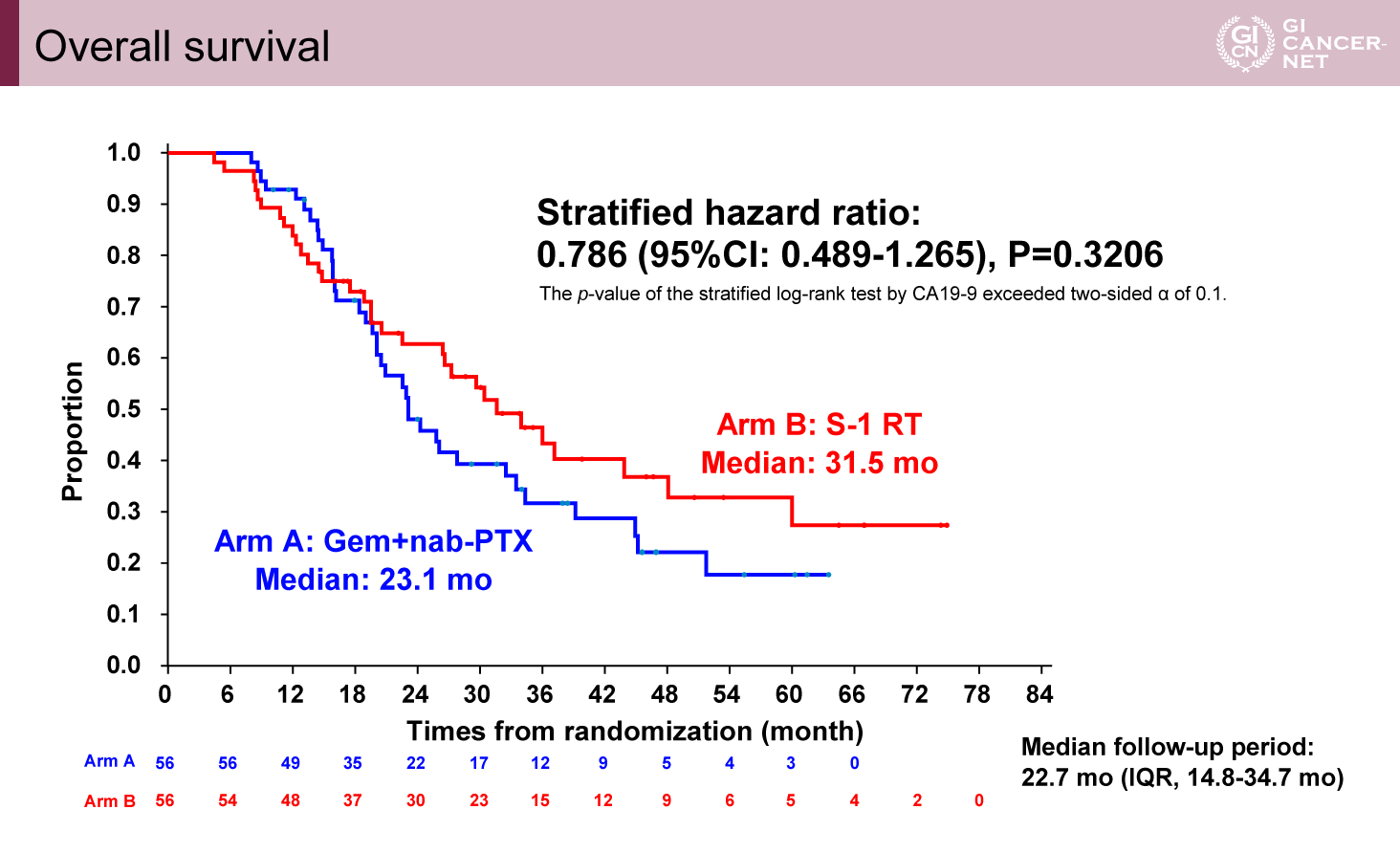
主要評価項目であるOS中央値はGemcitabine+Nab-Paclitaxel療法群23.1ヵ月に対し、S-1併用化学放射線療法群31.5ヵ月(HR=0.79、95% CI: 0.49-1.27、p=0.32)であり、統計学的な有意差は認めなかった。一方でKM曲線は16ヵ月付近でクロスしており、以降は一貫してS-1併用化学放射線療法が上をいく結果であった(図2)。PFS中央値はGemcitabine+Nab-Paclitaxel療法群12.6ヵ月に対し、S-1併用化学放射線療法群11.1ヵ月(HR=0.78、95% CI: 0.51-1.18)であり、KM曲線はOSと同様の傾向を認めた。R0切除割合はGemcitabine+Nab-Paclitaxel療法群60.7%、S-1併用化学放射線療法群57.1%(p=0.85)であり差はなかった。
有害事象については、grade 3以上の好中球減少はGemcitabine+Nab-Paclitaxel療法群で高頻度であり(75% vs. 5%)、食欲不振はS-1併用化学放射線療法群でやや高頻度であったものの大きな差は認めなかった(4% vs. 7%)。
図2 Overall survival(発表者の許可を得て掲載)
結論
切除可能境界膵癌に対して、Gemcitabine+Nab-Paclitaxel療法とS-1併用化学放射線療法はOSにおいて有意差を認めなかった。KM後半(約16ヵ月以降)ではS-1併用化学放射線療法が良好な傾向であり、一部の集団で長期生存に貢献している可能性があるものの、追跡期間中央値は22.7ヵ月であり、この確認にはさらなる追跡期間が必要である。日常診療においては引き続き両治療ともが治療オプションとなるものと考えられる。一方で、S-1併用化学放射線療法にはKM曲線上は、長期生存に寄与する可能性と早期死亡が多い可能性が示唆されるため、治療を層別化できる因子の探索も引き続き重要となってくるものと思われる。
(レポート:静岡県立静岡がんセンター 消化器内科 大場 彬博)
References
1) Ozaka M, et al.: Eur J Cancer. 181: 135-144, 2023 [PubMed]
2) Takahashi S, et al.: Ann Surg. 276(5): e510-e517, 2022 [PubMed]
関連サイト
・GABARNANCE試験[GABARNANCE TRIAL][UMIN-CTR]
・JCOG1407試験[統括報告書][jRCT]
寺島 健志先生
金沢大学 先進予防医学研究センター 特任准教授