Stage III結腸癌におけるctDNAに基づく術後補助化学療法の強化:無作為化第II/III相AGITG DYNAMIC-III試験におけるctDNA陽性コホートの主要解析
ctDNA-guided Adjuvant Chemotherapy Escalation in stage III Colon Cancer: Primary Analysis of the ctDNA-Positive Cohort from the Randomized AGITG DYNAMIC-III Trial (Intergroup Study of AGITG and CCTG)
Jeanne Tie, et al.
監修コメント
Stage III結腸癌の術後補助化学療法には、長年Oxaliplatin併用レジメンが標準とされ、特に高リスク例では6カ月間の投与が推奨されてきた。しかし、感覚性末梢神経障害などの後遺症への懸念も強く、再発リスク層別化とそれに基づく治療最適化が求められている。近年、circulating tumor DNA(ctDNA)による微小残存病変(MRD)の検出に基づく治療個別化が注目されており、ASCO 2025でもMRD関連の演題が数多く発表されていた。
DYNAMIC-III試験は、術後ctDNAの結果に応じて治療を調整する層別化戦略の有効性を検証した無作為化第II/III相試験である。今回発表されたのはctDNA陽性例に対してFOLFOXIRIや6カ月間のOxaliplatinを用いる治療強化(escalation)を行った群の解析結果である。特筆すべきは、単なる治療法の比較ではなく、ctDNA情報に基づく層別化の臨床的意義──すなわち、「検査の価値(testing the test)」──を前向きに検証している点にある。しかし、2年RFSの有意な改善は認められず、治療強化がctDNA陽性例に有効とは言難い、直感的な予測とは異なる結果になった。わずか250例でHR差を見込む設計自体に統計的な制約があり、背景因子の偏りを踏まえても、生存曲線上に明確な効果は確認されなかった。
本邦でもCIRCULATE-Japanの一環として、ctDNA陽性例を対象としたFTD/TPIとプラセボを比較した第III相ALTAIR試験が実施され、ASCO-GI 2025などで結果が報告されたが、こちらもRFS改善は示されなかった。全ゲノム解析を用いる試みなど検査精度は急激に進歩しているが、“治療介入”が未だ不十分である現状が、あらためて浮き彫りとなった。MOSAIC試験から20年、術後補助療法のレジメンに大きな変化はなく、ctDNAを含めたバイオマーカーに基づく個別化医療の実現には新たな治療選択肢の導入が不可欠である。今後は、抗体薬物複合体や個別化がんワクチンなど、分子標的治療・免疫療法の応用がDYNAMICな展開をもたらすことに期待したい。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
ctDNA情報に基づくstage III結腸癌の術後補助化学療法
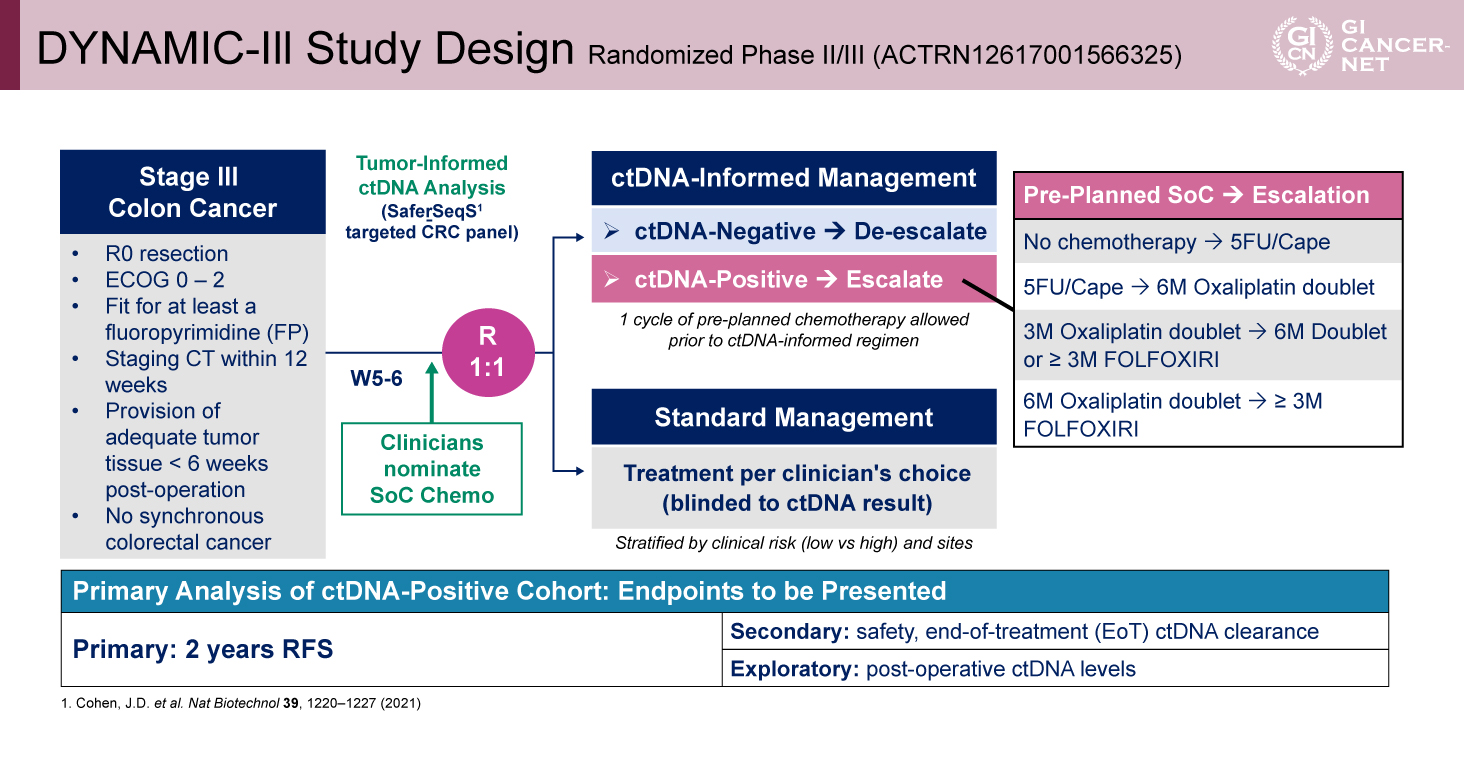
Stage III結腸癌では、Oxaliplatinベースの標準的な術後補助化学療法を行っても約30%の症例で再発が認められる1)。高リスクstage IIIにおいては、6カ月間のOxaliplatin併用療法が、3カ月間の治療に比べて再発抑制に優れることが報告されている1)。近年、術後の循環腫瘍DNA(ctDNA)ステータスは、強力な独立した予後因子であることが示されている2-4)。DYNAMIC-III試験では、stage III結腸癌におけるctDNA情報に基づく術後補助薬物療法の個別化を目的に、ctDNA陽性例には治療強化(escalation)を、陰性例には治療軽減(de-escalation)を行うデザインが採用された。
本報告では、ctDNA陽性例における主要解析結果を示す。
術後ctDNA陽性例における、標準的補助化学療法に対するescalationのRFS上の優越性を検証
適格基準は、R0切除、ECOG PS 0-2、Fluoropyrimidineの投与に適格、術後6週未満に十分量の腫瘍組織の提供が可能である等であった。患者はctDNA情報に基づく治療群と標準治療(SOC)群に1:1で無作為に割り付けられた。無作為化前に担当医がSOC群における術後補助化学療法レジメンを選択した。ctDNA情報に基づく群では、術後5〜6週目に実施したアッセイでctDNA陽性と判定された場合、治療強化(escalation)が行われた(化学療法なしからFluoropyrimidine単剤へ、Fluoropyrimidine単剤から6カ月のOxaliplatin併用2剤療法へ、3カ月のOxaliplatin併用2剤療法から6カ月への延長または3カ月以上のFOLFOXIRIへ、6カ月のOxaliplatin併用2剤療法から3カ月以上のFOLFOXIRIへの変更)。
主要評価項目は2年無再発生存率(RFS)、副次評価項目は安全性、治療終了時におけるctDNAの消失であった。また探索的に術後ctDNAのレベルが評価された。250例のサンプルサイズにより、ハザード比(HR)0.746未満であれば90%信頼区間(CI)および80%の検出力でSOC群に対するEscalation群の優越性を検証可能とした(図1)。
図1 DYNAMIC-III Study Design(発表者の許可を得て掲載)
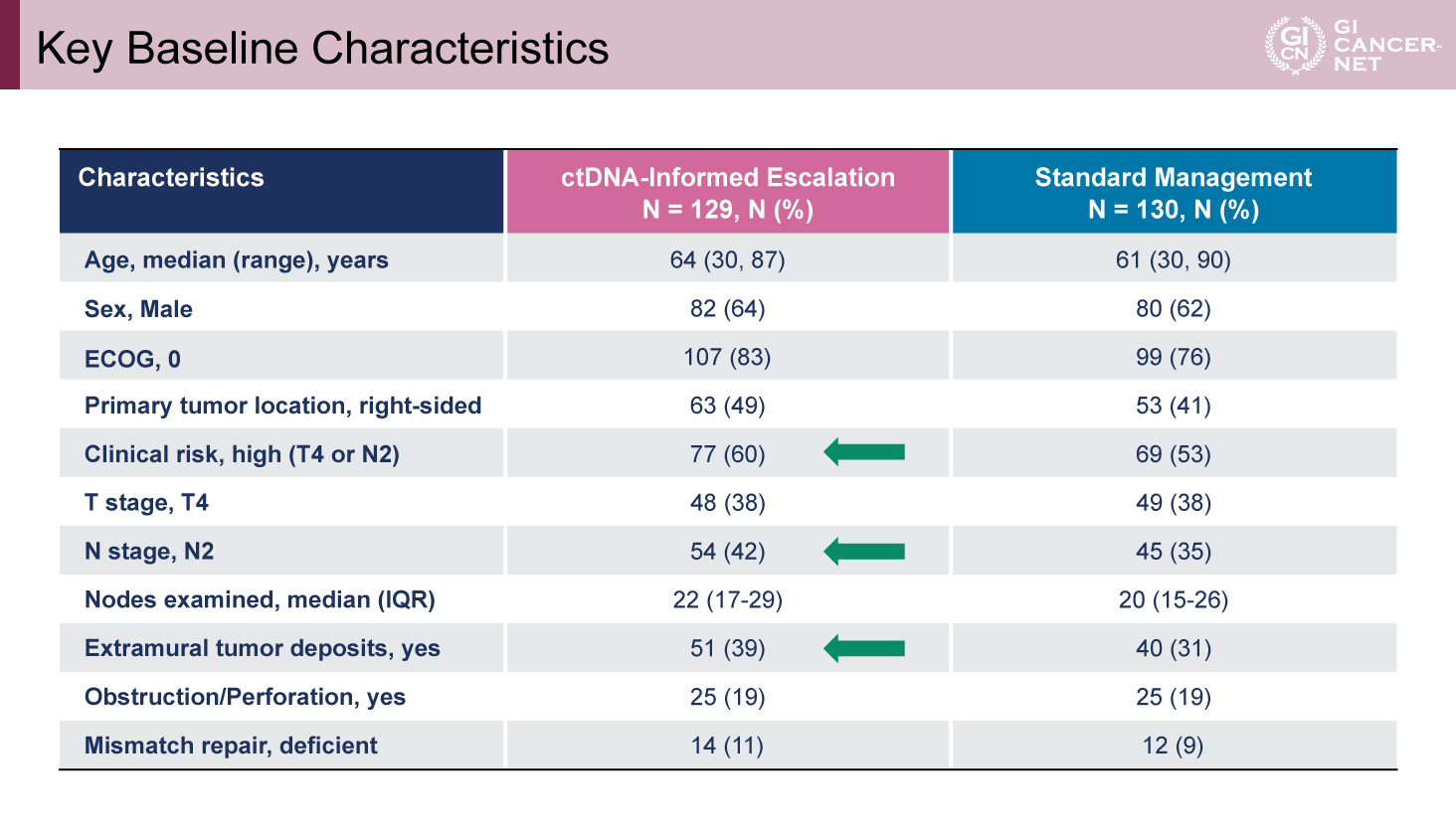
登録患者の背景および治療実施状況
Escalation群129例、SOC群130例が登録され、患者背景はほぼ均衡していた。ただし、臨床的再発高リスク(T4 or N2)のうち、N2症例はEscalation群に多く(42% vs 35%)、腸管外腫瘍結節(extramural tumor deposits)を有する症例も多かった(39% vs 31%)(表)。Escalation群では115例(89%)が実際に治療強化を受け、そのうち65例(50%)がFOLFOXIRI、56例(44%)が6カ月間のOxaliplatin併用療法であった。SOC群では、59例(45%)が3カ月、53例(41%)が6カ月のOxaliplatin併用療法を受けた。
表 Key Baseline Characteristics(発表者の許可を得て掲載)
Escalation群におけるRFS改善は認められず
中央値42.2カ月の追跡において、2年RFSはEscalation群で52%(90% CI: 44-59)、SOC群で61%(90% CI: 54-68)であり、HR=1.11(90% CI: 0.83-1.48、p=0.57)と統計学的有意差は認められなかった(図2)。事後解析では、FOLFOXIRIとFOLFOX/CAPOXを比較し、3年RFSはそれぞれ47%、51%であり、HR=1.09(90% CI: 0.78-1.53、p=0.662)と有意差を認めなかった。
RFSのサブグループ解析では、T stage(T4 vs T1-3)における交互作用が示唆され(p=0.0627)、T4例ではSOC群が良好であった(HR=1.63、95% CI: 1.05-2.54)。治療終了時のctDNAの消失の有無によるRFSのランドマーク解析では、ctDNAが消失した症例では3年RFSが84%、残存した症例では12%、HR=11.1(90% CI: 6.7-20、p<0.0001)と有意差が認められた(図3)。
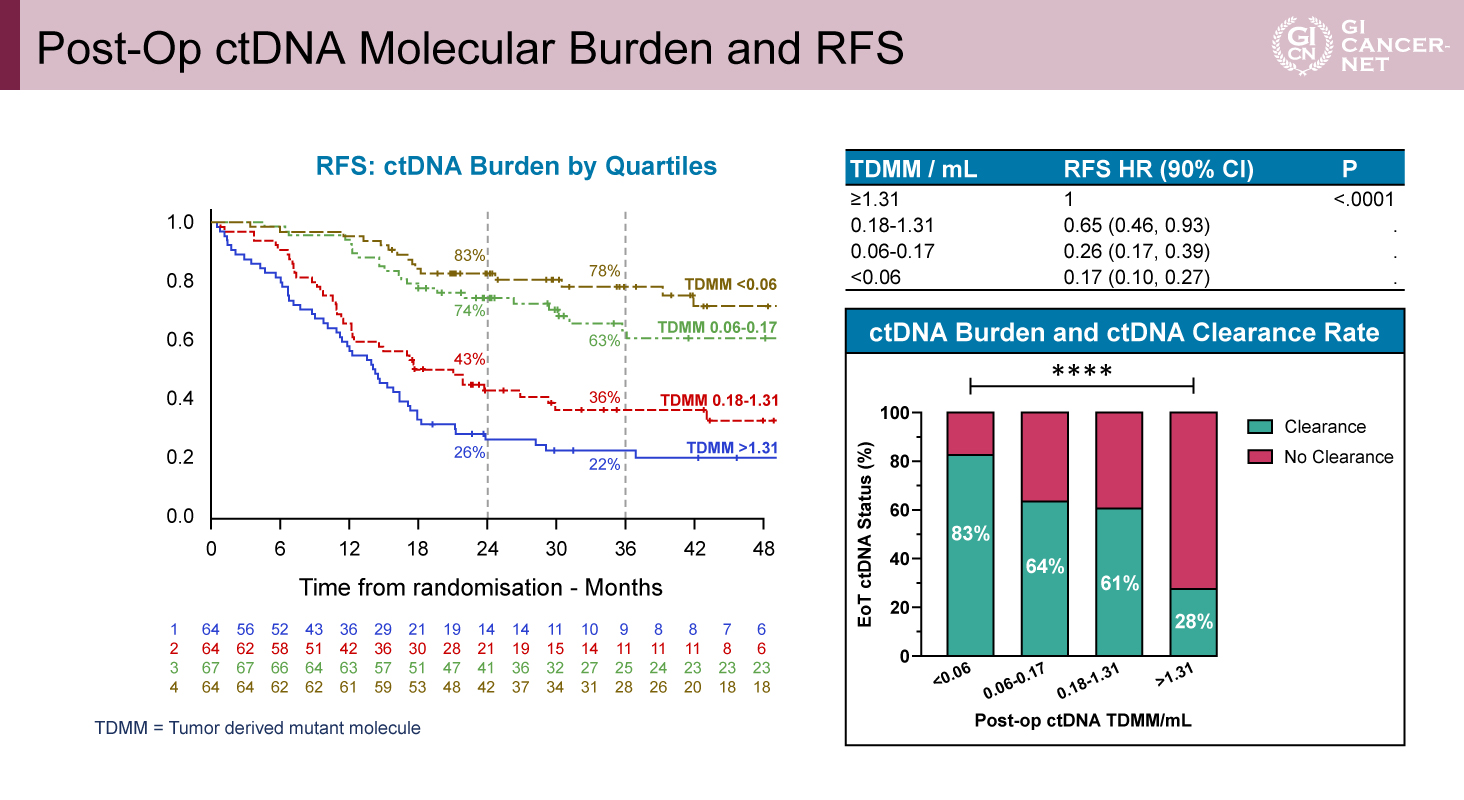
また、術後ctDNA量が少ないほどRFSは良好であり、3年RFSはtumor derived mutant molecule(TDMM)<0.06で78%、TDMM 0.06-0.17で63%、TDMM 0.18-1.31で36%、TDMM>1.31で22%であった(p<0.0001)。治療終了時のctDNA消失率も術後ctDNA量と逆相関し、TDMM<0.06では83%、TDMM 0.06-0.17では64%、TDMM 0.18-1.31では61%、TDMM>1.31では28%であった(図4)。
図2 Recurrence-Free Survival(発表者の許可を得て掲載)
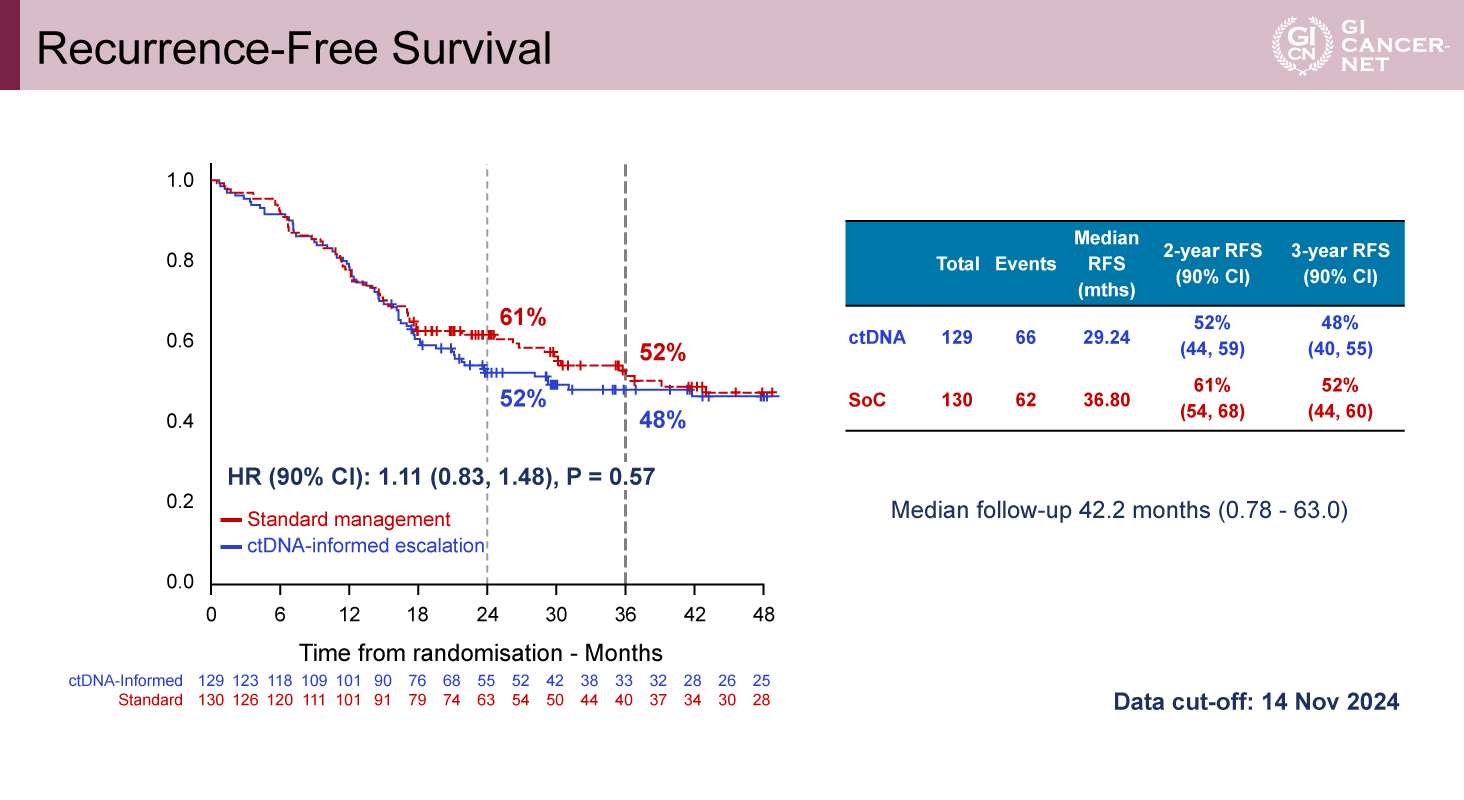
図3 End of Treatment (EoT) ctDNA Clearance and RFS(発表者の許可を得て掲載)
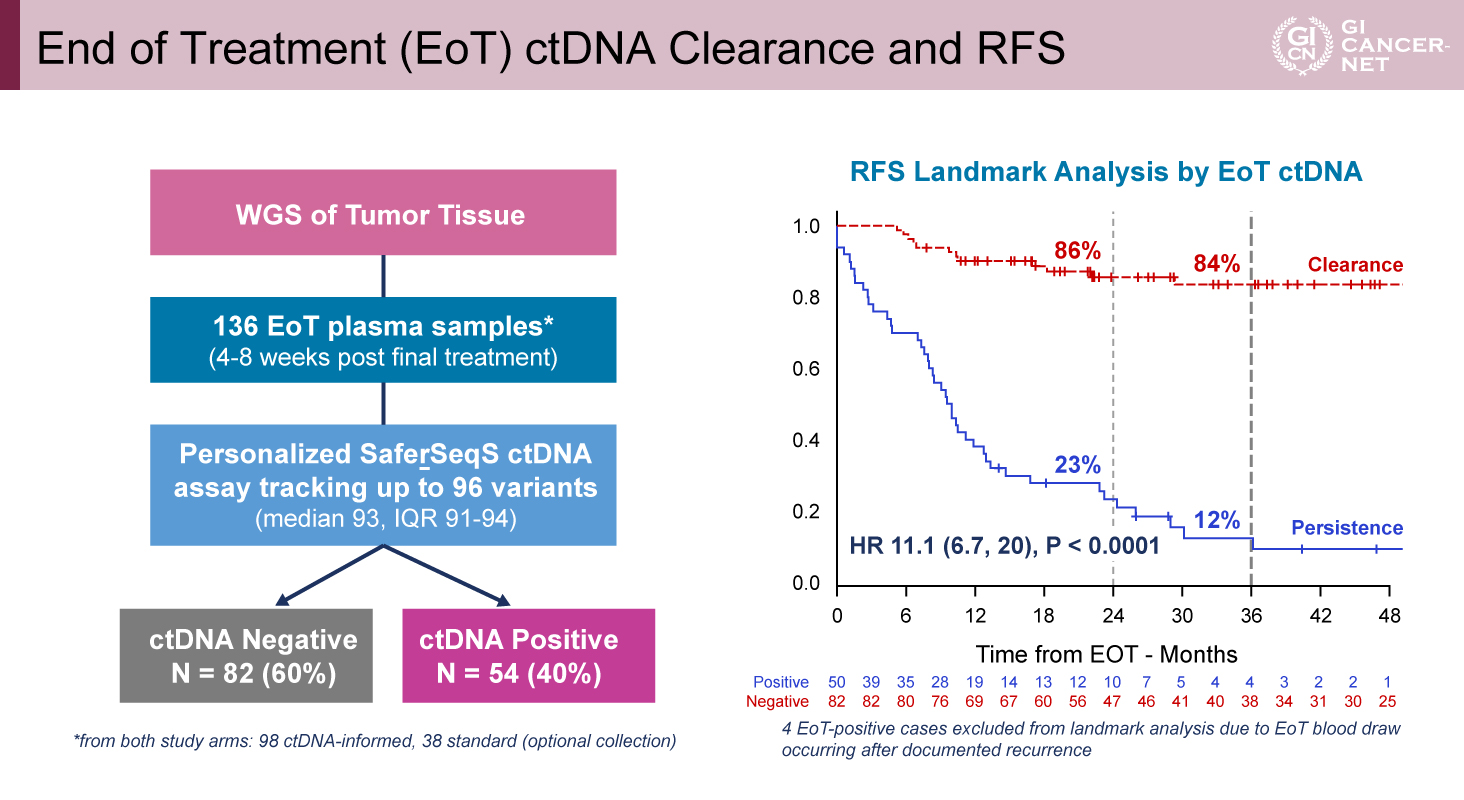
図4 Post-Op ctDNA Molecular Burden and RFS(発表者の許可を得て掲載)
結論
術後ctDNA陽性であったstage III結腸癌症例では、再発リスクが依然として高く、ctDNA量が多いほど再発リスクも上昇した。ctDNA情報に基づく術後補助薬物療法の治療強化は、再発抑制効果を有意に高める結果とはならなかった。
(レポート:愛知県がんセンター 薬物療法部 水野 太朗)
References
1) André T, et al.: Lancet Oncol. 21(12): 1620-1629, 2020 [PubMed]
2) Tie J, et al.: Sci Transl Med. 8(346): 346ra92, 2016 [PubMed]
3) Nakamura Y, et al.: Nat Med. 30(11): 3272-3283, 2024 [PubMed]
4) Taieb J, et al.: J Clin Oncol. 43(13): 1564-1577, 2025 [PubMed]
谷口 浩也先生
愛知県がんセンター
薬物療法部 医長