切除可能な大腸癌腹膜転移に対する周術期全身化学療法の有効性を検証した多施設共同ランダム化第III相試験(CAIRO6試験)
Perioperative systemic therapy for resectable colorectal peritoneal metastases: a multicenter randomized phase 3 trial (CAIRO6)
Ignace De Hingh, et al.
監修コメント
切除可能な大腸癌腹膜転移に対する治療戦略は、依然として臨床現場で議論が絶えない領域である。『大腸癌治療ガイドライン2024年版』では、軽度から中等度の腹膜転移に対して外科的切除が推奨されているものの、周術期薬物治療の有用性は明確でなく、肝転移と同様に術後補助化学療法が弱く推奨されるにとどまっている。また、CRS+HIPECに関しては、国内における治療実績が乏しく、ガイドライン上でも明確な推奨はされていない。
CAIRO6試験は、CRS+HIPECを標準治療と位置づけ、さらに周術期全身薬物療法の上乗せ効果を検証したランダム化第III相試験である。結果として、再発抑制効果は認められたものの、有意な生存改善には至らなかった。
本試験結果は、肝転移例における術後補助療法の意義を検証したJCOG0603試験を彷彿とさせる。転移臓器の違いはあるが、いずれも再発抑制効果が示された一方で、生存期間の延長には繋がらなかった点は共通している。もっとも、肝転移では再発後の再肝切除など多様な選択肢が存在するが、CAIRO6試験において、再発形式や術後補助療法実施割合、用量強度がどのようであったのかは検討を要する。発表スライドにはCensorの記載がなく、イベント数の詳細な把握が困難であったが、生存曲線の後半部分は全身化学療法群のカーブがやや上回るようにも見受けられた。また、発表されたサブグループ解析において、特定集団における周術期薬物療法の有用性が示唆されており、検出力の不足によって有意差がとらえきれなかったのではないかという疑念は残る。
本試験の結果は、実地診療において腹膜転移切除後の補助療法を一律に否定するものではないが、積極的に薦められるものではないだろう。ただし、有用性を裏付ける決定的なエビデンスが存在しない以上、これまで通り患者の治療歴や治療リスクを踏まえ、SDM(Shared Decision Making)に基づいた個別化治療が求められるだろう。比較的希少な対象に対して、このように第III相試験を完遂した研究グループの努力には、心からの敬意を表したい。
(愛知県がんセンター 薬物療法部 医長 谷口 浩也)
腹膜転移に対するCRS+HIPEC、周術期全身化学療法
大腸癌の約10%には腹膜転移が認められ、切除不能大腸癌の24%が腹膜転移を有するとの報告もある。腹膜転移は、画像診断や治療効果の評価が難しく、肺や肝転移に比べて治療抵抗性が高く予後不良であることから、大腸癌治療における重要課題の一つである。腹膜外転移を伴わない切除可能な症例に対しては、腹膜切除術(Cytoreductive Surgery: CRS)と腹腔内温熱化学療法(Hyperthermic Intraperitoneal Chemotherapy: HIPEC)の併用が長年検討されてきた。Verwaalらによる初期のランダム化試験では、105例をCRS+HIPEC群と標準治療(5FU/LV±緩和的手術)群に割り付け、CRS+HIPEC(Mitomycin C)群の全生存期間(OS)中央値は22.3カ月と、標準治療群の12.6カ月より有意に延長していた(ハザード比[HR]0.55、95%信頼区間[CI]0.32-0.95、p=0.032)1)。
一方、CRS+HIPEC群では治療関連死亡率が8%と高く、長期フォローアップでは明確な生存改善は示されなかった。また、この試験はOxaliplatinやIrinotecan、各種分子標的薬等を用いない時代に行われたものであり、現在の治療環境下での有効性は不明のままである。欧米ではCRS+HIPECは切除可能な腹膜転移に対して広く行われており、周術期に全身化学療法を併用する意義も検討されているが、有用性を裏付ける質の高いエビデンスは少なく、最適なレジメンや投与期間は確立されていない2)。
こうした中、切除可能大腸癌腹膜転移に対しCRS+HIPECに周術期全身化学療法(CAPOX or FOLFOX or FOLFIRI+術前Bevacizumab)を併用する意義を第III相ランダム化試験で検証したのがCAIRO6試験である。
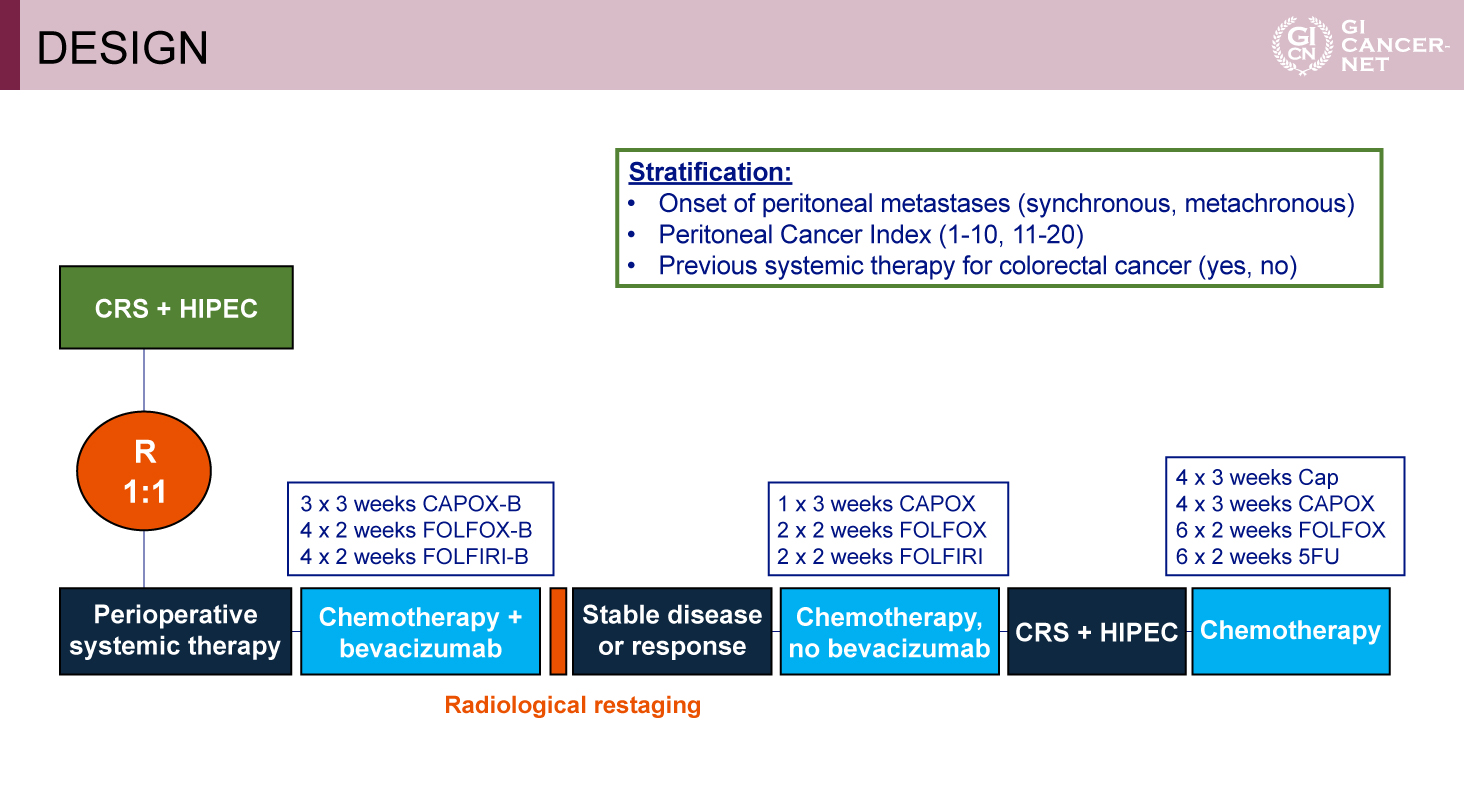
CRS+HIPECを標準治療群とし、OSの優位性を検証する試験デザイン
本試験はオランダおよびベルギーの研究グループによって実施された。対象は、登録前6カ月以内に全身化学療法を受けていない、腹膜播種係数(Peritoneal Cancer Index: PCI)≦ 20、切除可能かつ腹膜以外に転移を認めない、PS 0-1の大腸癌患者であり、CRS+HIPEC+周術期全身化学療法併用群(化学療法併用群)とCRS+HIPEC単独群(標準治療群)に1:1でランダムに割り付けた(図1)。診断時から同時性(synchronous)に腹膜転移を有する症例に加え、治療中に異時性(metachronous)に腹膜転移を生じた症例も含まれた。化学療法併用群では、術前治療としてCAPOX、FOLFOXまたはFOLFIRIを選択し、Bevacizumabを併用して(最初の3または4サイクル)12週の治療を行い、術後はBevacizumab抜きの同一レジメンを12週実施した。PRODIGE 7試験の結果を受けてHIPECにはMitomycin C(35mg/m2、90min)が使用された。
主要評価項目はOS、副次評価項目として無増悪生存期間(PFS)、術後90日以内の重篤な有害事象(Clavien-Dindo分類)および術後死亡率が設定された。統計設定として、周術期全身化学療法併用により3年OS率が50%から65%に改善すると期待し、両側有意水準0.05、検出力80%、脱落率5%を考慮し、各群179例の登録が必要と算出された。最終的なOSの解析は、171件の死亡イベント到達時点で実施され、検出力は88%に達した。
図1 Design(発表者の許可を得て掲載)
周術期全身化学療法併用群でOSは延長せず
ランダム化された358例のうち、最終的な解析対象は351例であった(化学療法併用群173例、標準治療群178例)(図2)。各群には、腫瘍切除を行わず閉腹に至った症例がそれぞれ20例、24例含まれていた。患者背景は両群でおおむね均衡しており、原発巣の部位や病理組織型を含め群間で有意な差は認められなかった(表1、表2)。
追跡期間中央値41カ月時点におけるOS中央値は、化学療法併用群44カ月、標準治療群39カ月であり、3年OS率はそれぞれ54%および53%と、主要評価項目であるOSにおいて統計学的有意差は認められなかった(HR=0.85、95% CI: 0.62-1.15、p=0.28)(図3)。
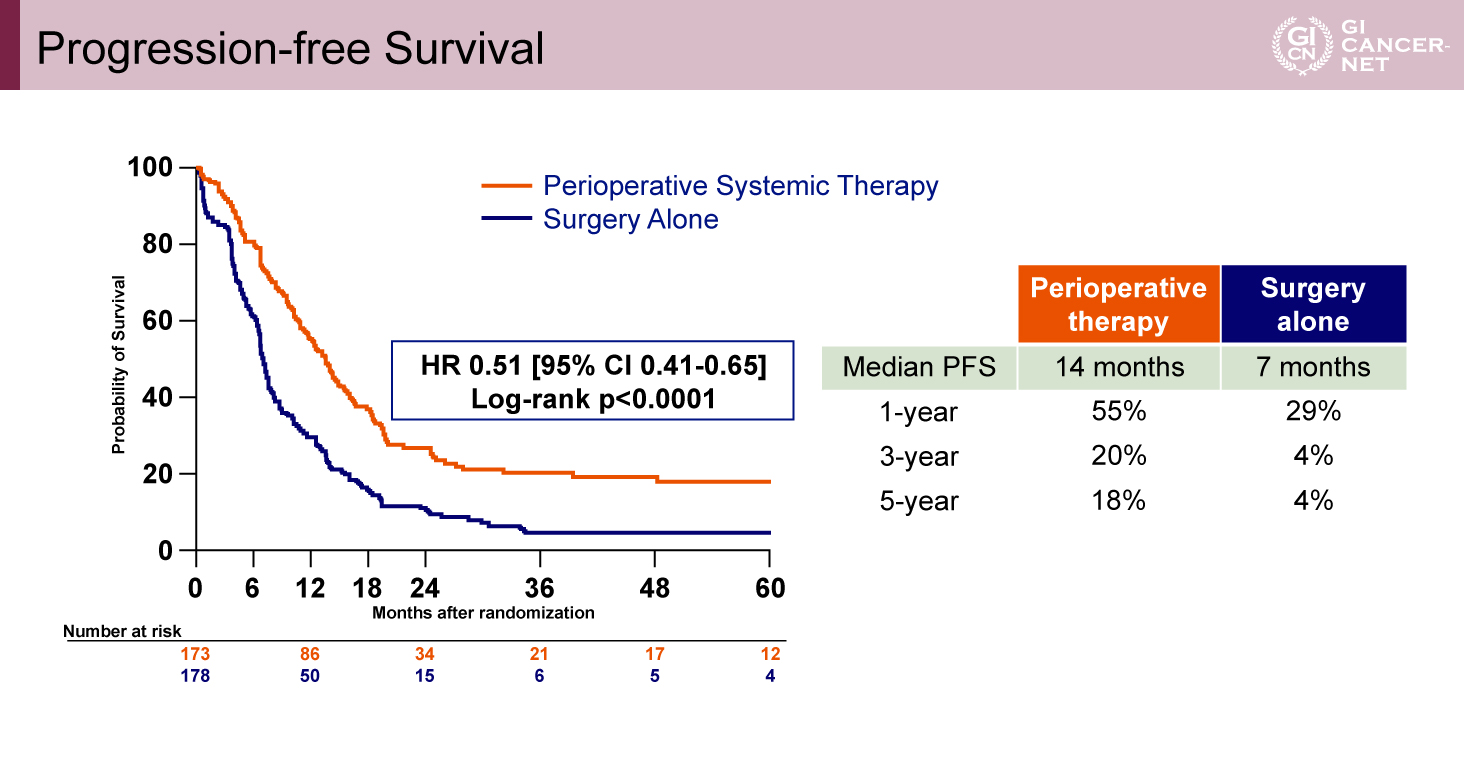
一方でPFSの中央値は、化学療法併用群14カ月、標準治療群7.0カ月と有意な延長傾向を認めた(HR=0.51、95% CI: 0.41-0.65、p<0.0001)(図4)。
図2 FLOWCHART(発表者の許可を得て掲載)
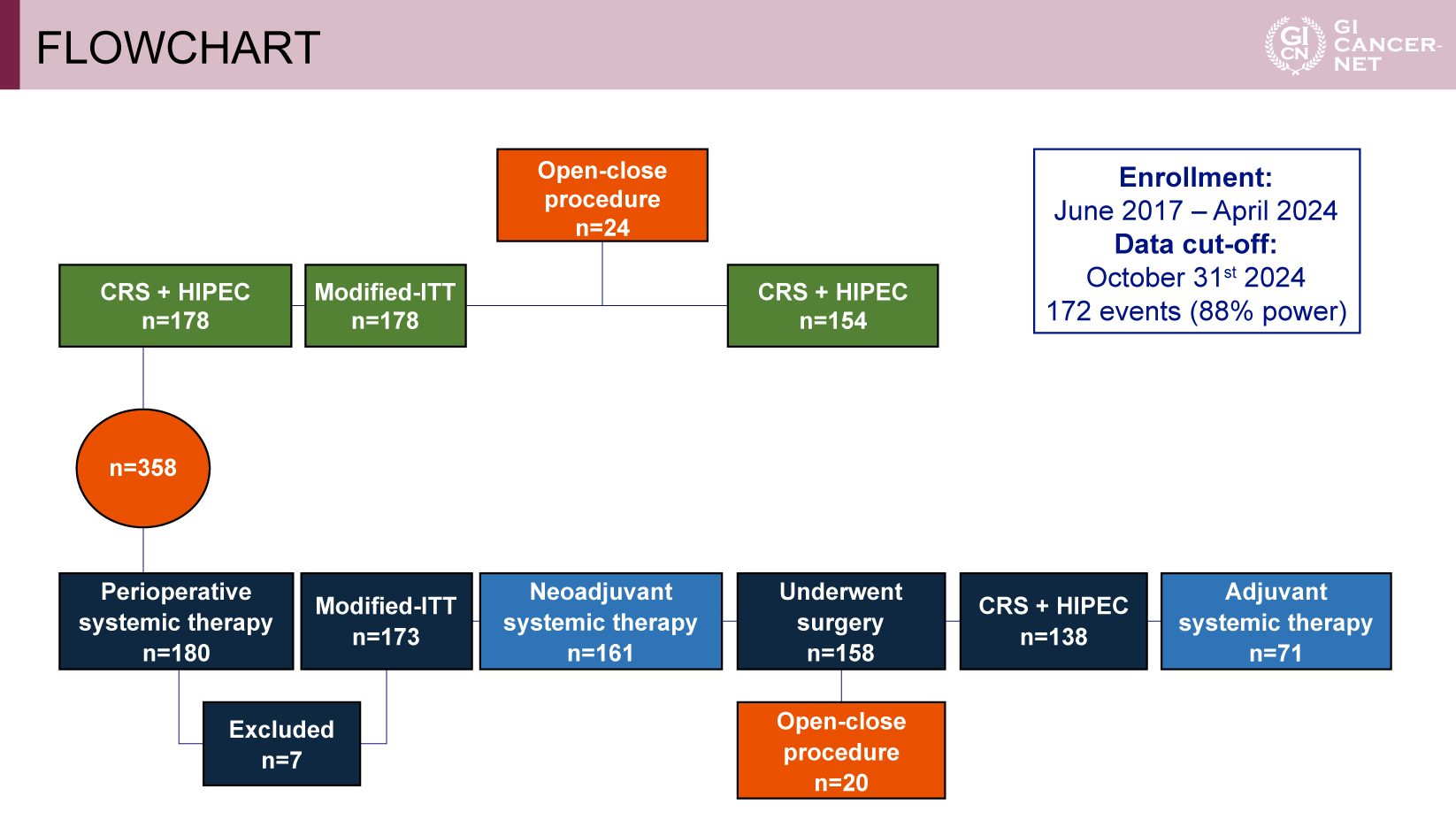
表1 Patient characteristics(発表者の許可を得て掲載)
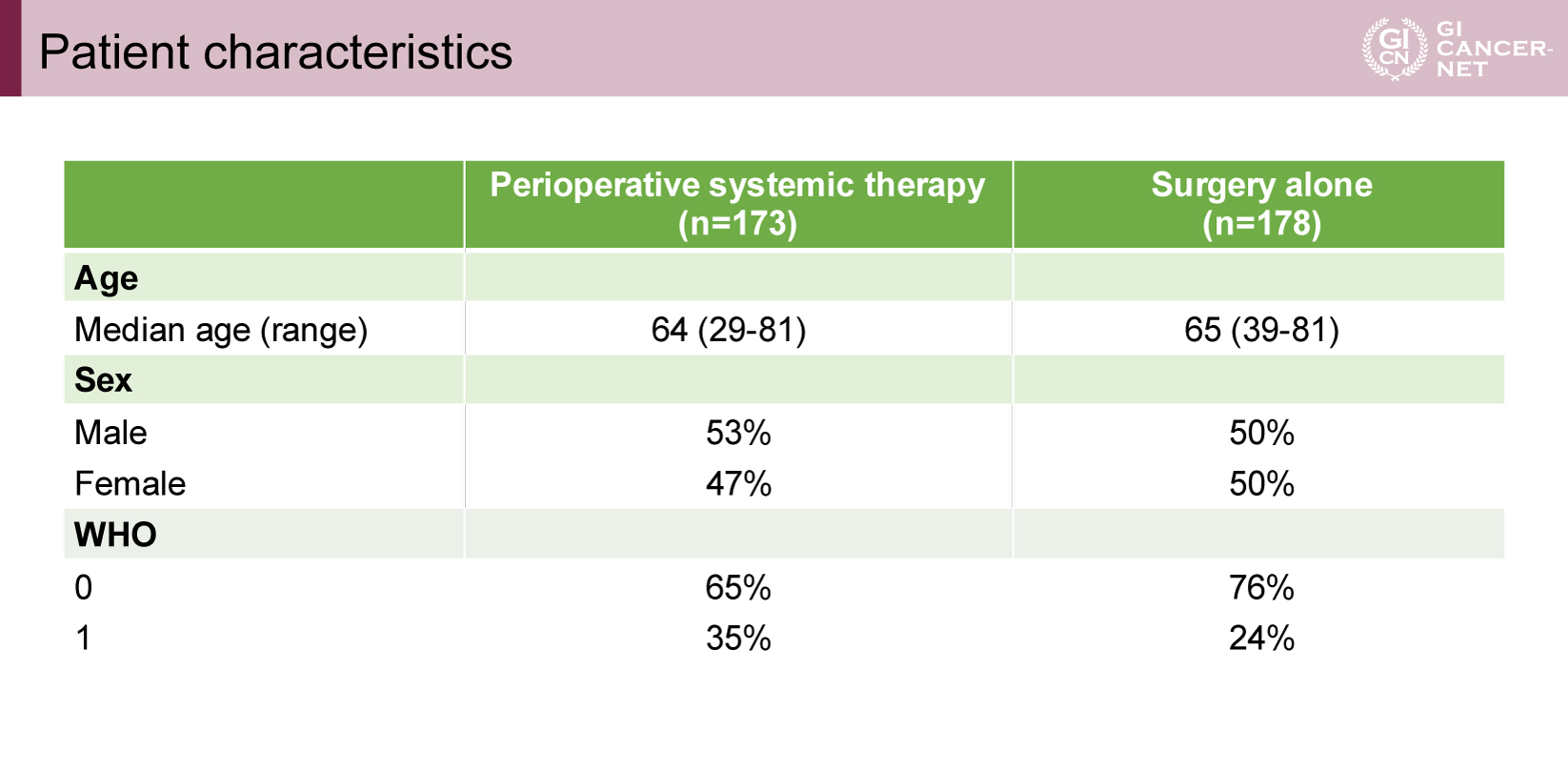
表2 Tumor characteristics(発表者の許可を得て掲載)
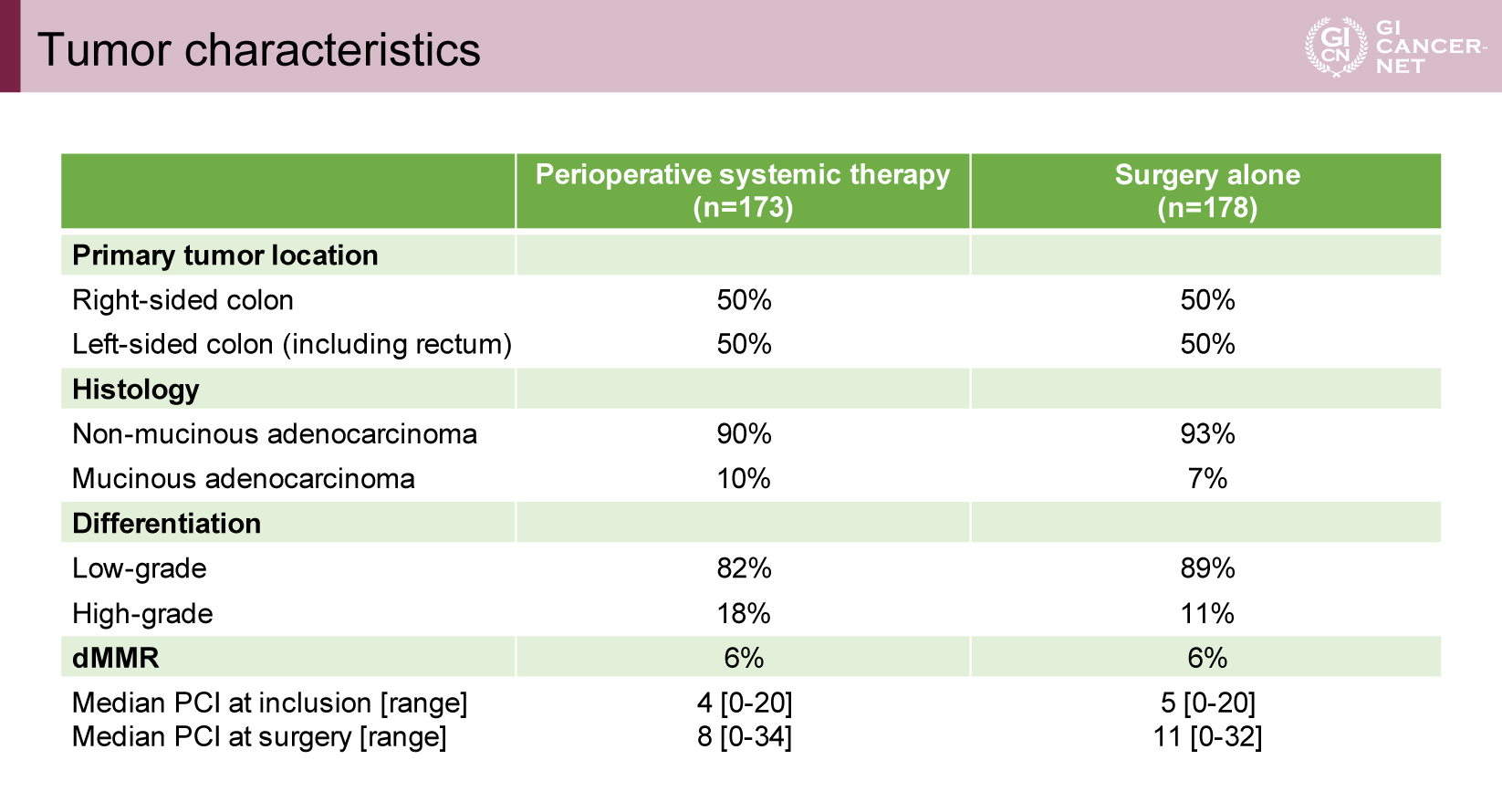
図3 Overall Survival mITT Population(発表者の許可を得て掲載)
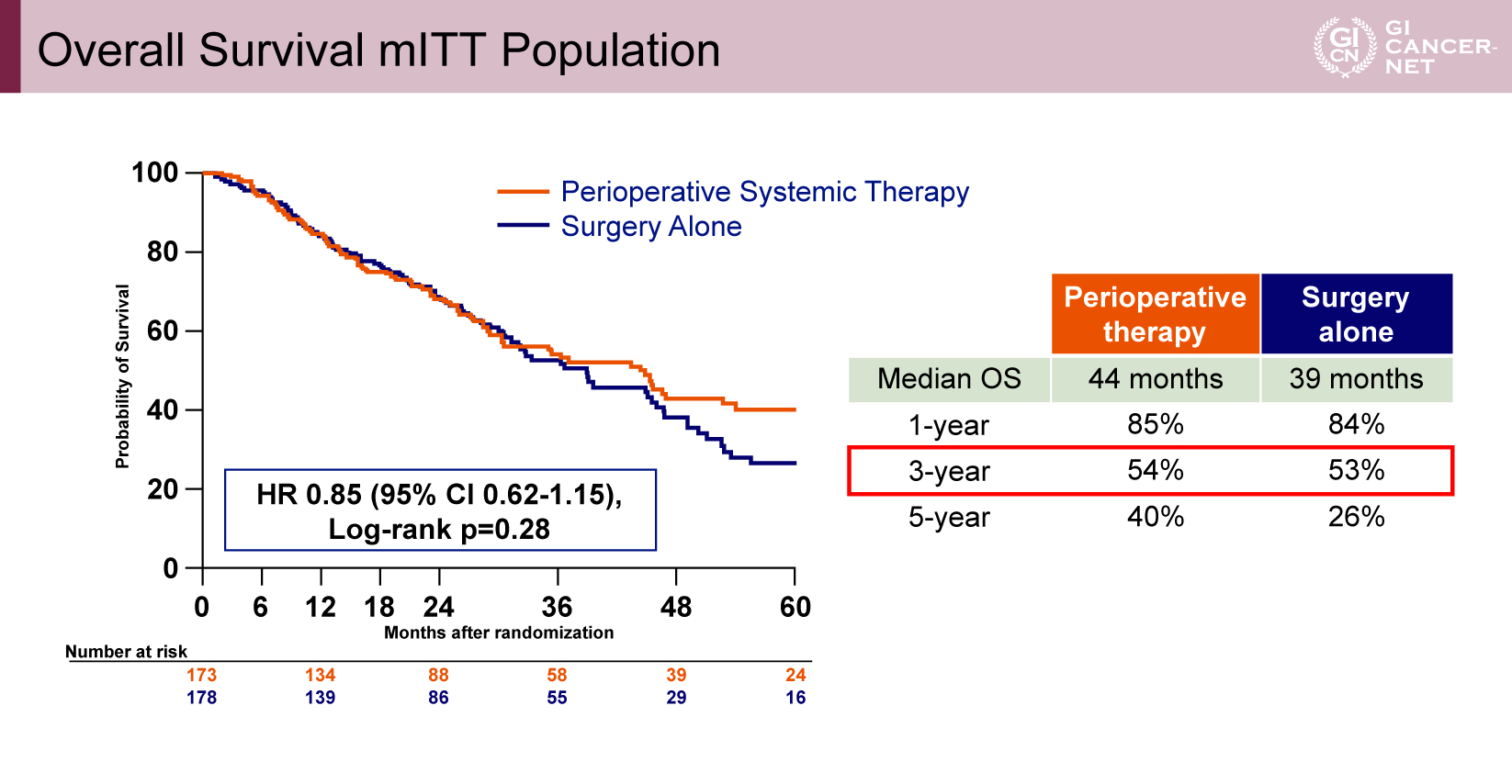
図4 Progression-free Survival(発表者の許可を得て掲載)
周術期治療による有害事象の増加傾向あり
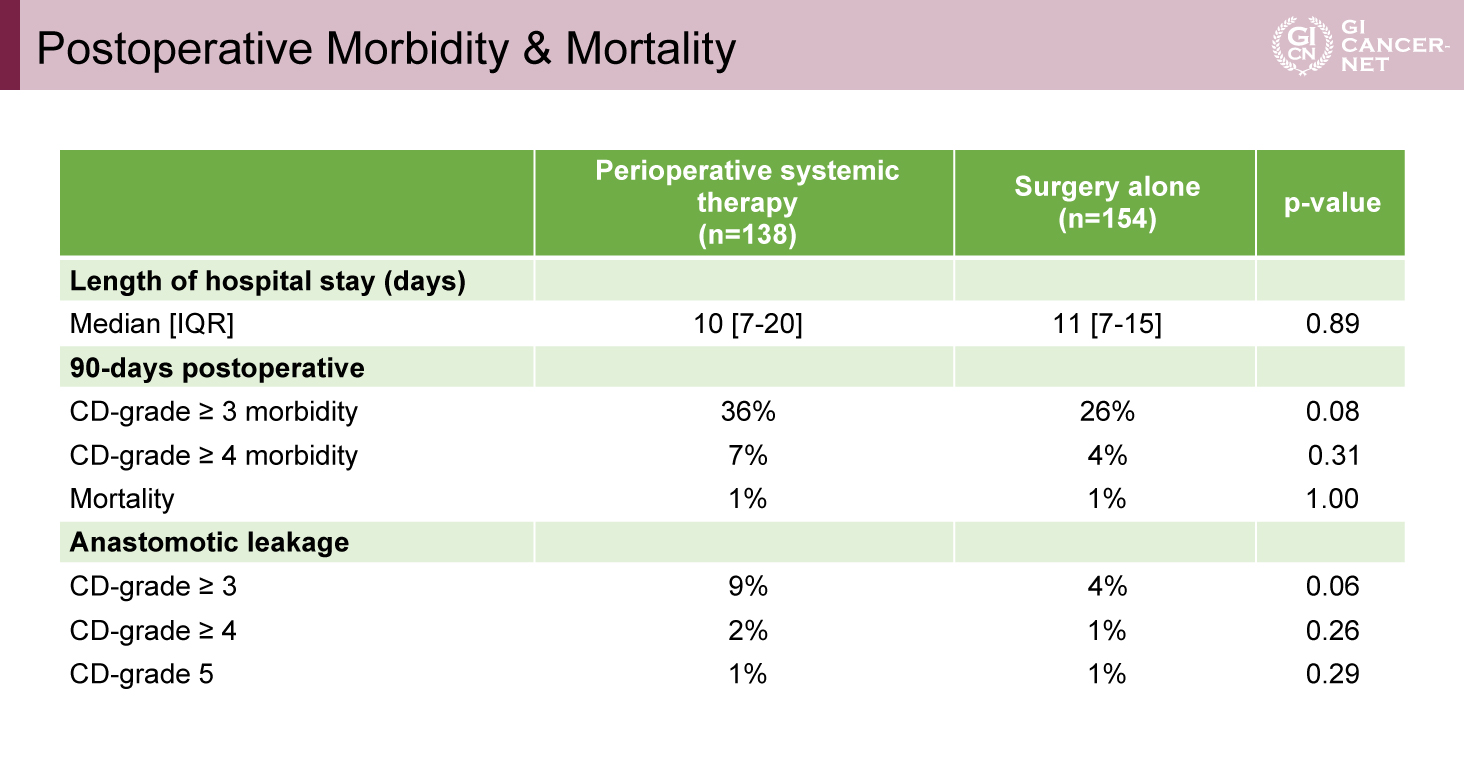
術後90日以内の重篤な合併症は、化学療法併用群36%、標準治療群で26%と化学療法併用に伴い増加傾向がみられたが、統計学的な有意差は認められなかった(表3)。また、術後縫合不全も、化学療法併用群でやや多い傾向を認めたが、有意差はなかった。術後90日以内の死亡率は両群とも1%であった。
表3 Postoperative Morbidity & Mortality(発表者の許可を得て掲載)
診断時に腹膜転移を有する右側原発の大腸癌患者で特に有効である可能性
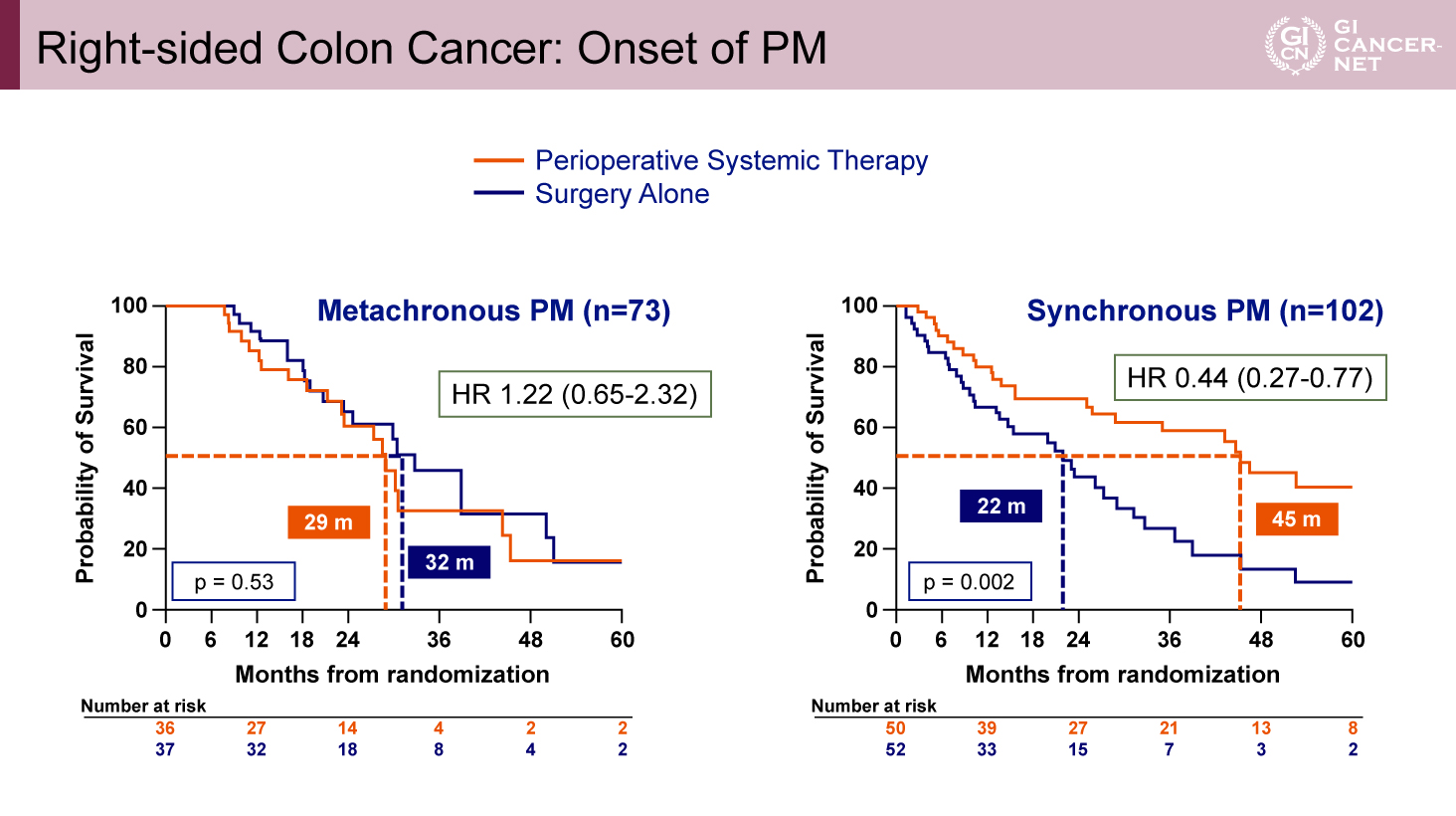
サブグループ解析では、周術期全身化学療法の併用効果は右側原発症例でより顕著であり、特に診断時から腹膜転移を認める同時性(synchronous)症例において、有効性が高い可能性が示唆された(HR=0.44、95% CI: 0.27-0.77、p=0.002)(図5)。
図5 Right-sided Colon Cancer: Onset of PM(発表者の許可を得て掲載)
結論
切除可能大腸癌腹膜転移に対するCRS+HIPECに周術期全身化学療法を追加しても、OSの有意な延長は認められなかった。
(レポート:愛知県がんセンター 薬物療法部 安藤 泰樹)
References
1) Verwaal VJ, et al.: J Clin Oncol. 21(20): 3737-3743, 2003[PubMed]
2) Rovers KP, et al.: Crit Rev Oncol Hematol. 114: 53-62, 2017[PubMed]
関連サイト
・CAIRO6試験[ClinicalTrials.gov]
・PRODIGE 7(ACCORD-15)試験[ClinicalTrials.gov][学会レポート]
谷口 浩也先生
愛知県がんセンター 薬物療法部 医長